产品中心
技术交流

扫描二维码
炎症小体——Caspase-1活化支架


炎症小体是一种高分子量复合物,它可以激活炎性胱天蛋白酶并激活IL-1家族细胞因子。目前已发现部分NLR家族内的炎症小体,包括NLRP1(NALP1)、NLRP3(NALP3)、IPAF(NLRC4)。有趣的是,最近发现的AIM2(黑色素瘤缺乏因子)并不包含在NLR家族内。炎症小体可通过多种信号激活,包括活细菌、微生物毒素、异源化合物、PAMPs、DAMPs。这表明NLRP3的LRR结构域介导自动阻遏,可能是由SGT1与HSP90分子伴侣通过将NLRP3维持在失活但具备信号功能的状态。在检测到它们各自的配体后,NLRP1或NLRP3会通过NACHT结构域寡聚化,由于同型PYD-PYD相互作用,导致PYD聚集和衔接蛋白ASC(含有CARD的细胞凋亡相关斑点样蛋白)聚集。聚集在AIM2的情况下,寡聚化很可能是通过聚集在dsDNA内的多个结合位点介导的,而并非类似于NACHT那种中央寡聚化结构域介导。然而,AIM2寡聚化同样也通过同型PYD-PYD相互作用导致ASC聚集。ASC包含一个N末端PYD结构域和一个C末端CARD结构域,可以通过同型CARD-CARD相互作用聚集炎性胱天蛋白酶。因此,炎性胱天蛋白酶紧密接近,自动活化形成活性胱天蛋白酶。在procaspase-1的情况下,活性胱天蛋白酶在自动切割后形成p10 / p20四聚体。除了caspase-1,NLRP1还可以聚集caspase-5到复合物中,但是caspase-5的作用仍在争议当中。与NLRP1、NLRP3和AIM2相反,IPAF不会聚集衔接分子,而是直接通过其CARD结构域与procaspase-1相互作用(见下图)。但是,根据IPAF刺激,IPAF下游的 caspase-1最大程度的活化可能需要ASC或NAIP 。不同炎症小体的组装引发了共同的下游级联反应,即炎性胱天蛋白酶的活化。这些活化的炎性胱天蛋白酶包括人类caspase-1、-4、5,小鼠caspase-1、-11、-12。但是,caspase-1似乎是与炎症小体相关的最主要的炎性胱天蛋白酶。炎性胱天蛋白酶均具有CARD结构域,随后是含催化半胱氨酸残基结构域,而且之所以被称之为炎性胱天蛋白酶,是因为他们的主要底物是被切割成活跃可分泌形式的细胞因子(例如pro-IL-1β、pro-IL-18和pro-IL-33)。此外,活化的炎症小体会导致某些细胞类型的宿主细胞死亡,例如细胞凋亡。细胞凋亡在限制侵入性病原体在细胞内的复制中尤为重要。
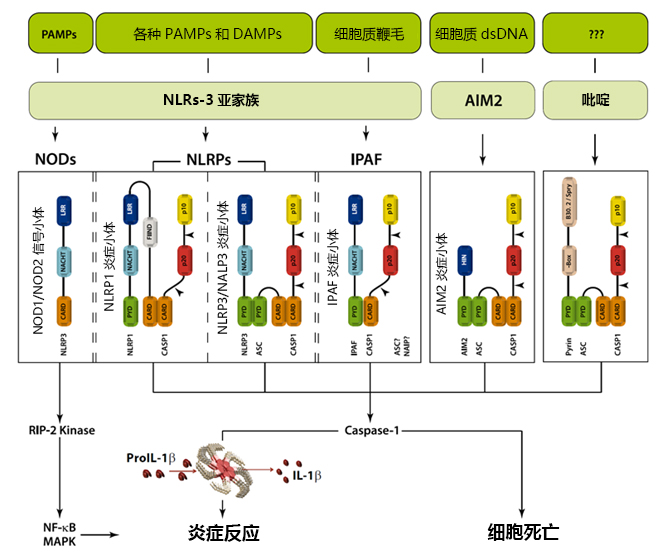
图1. 危险信号或细菌化合物可作为炎症小体和NODs的激动剂。
◆炎症小体——活性调节
尽管调节炎症小体活性的机制仍然难以捉摸,但是已经鉴定出各种可能干扰炎症小体活化和依赖炎症小体的胱天蛋白酶加工的蛋白。通常,可以分为两种炎症小体调节亚型,即含有CARD结构域的亚型和具有PYD结构域的亚型。此类蛋白质不仅包含宿主衍生的炎症小体调节剂,而且还包含多种抑制caspase-1活化和病毒性PYD蛋白质的细菌毒力因子。
◆炎症小体——治疗意义
由于IL-1β与其他细胞因子是炎症反应的关键因素,因此不难推测出IL-1β、炎性胱天蛋白酶和炎症小体在几种疾病中发挥着重要的作用(见下图)。实际上,某些人类遗传性疾病或获得性疾病与IL-1β升高有关,其中一些疾病可以使用IL-1β或其受体的拮抗剂进行治疗。很多疾病,如冷卟啉相关周期性发热综合征(CAPS),与NLRP3突变有着直接的关联。此外,痛风作为一种以关节严重发炎为病征的自发性疾病,则与MSU晶体在关节中的沉积有关。由于MSU是一种有效的NLRP3炎症小体激动剂,因此可以相信由炎症小体调节的IL-1β导致了痛风发作。此外,NLRP3炎性小体分泌的IL-1β是由B细胞中较高的细胞外葡萄糖触发的。。IL-1β升高是导致二型糖尿病(T2DM)发病的危险因素,同时有助于胰岛素抵抗。因此,作为代谢应激传感器的NlRP3炎症小体,很可能以尿酸单钠(MSU)或高血糖的形式,分别作用于痛风或T2DM的发病。另外,一些炎症小体调节剂在疾病中具有重要意义。经证明,患有FMF(家族性地中海热)的患者体内的吡啶是突变的。自身炎性疾病PAPA(化脓性关节炎,坏疽性脓皮病和痤疮)中IL-1β水平升高与一种与吡啶相互作用蛋白——PSTPIP1突变有关。总而言之,这表明吡啶和炎症小体调节剂在自身炎性疾病中的重要性,并可能为疾病治疗提供新的切入点。
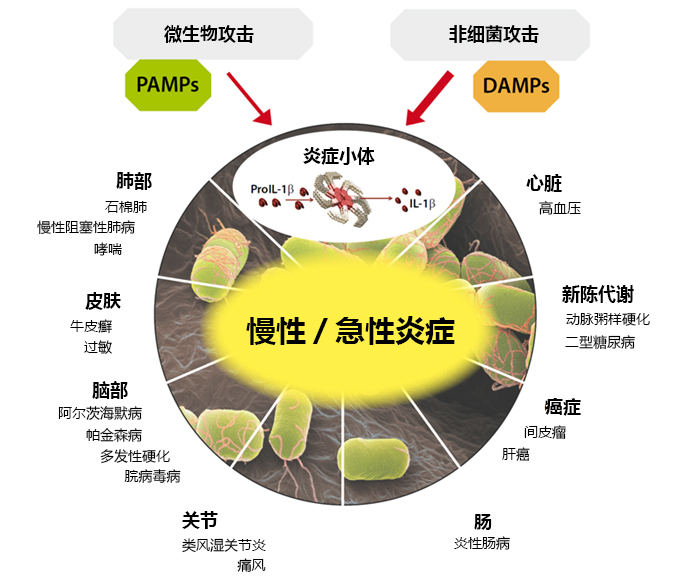
图2. 炎症小体相关疾病总览
◆炎症小体及其信号传导的详细内容
NLRP1炎症小体
最近研究显示抗凋亡蛋白Bcl-2和Bcl-XL可以结合并抑制NLRP1。Bcl-2和Bcl-XL抑制ATP与NLRP1的结合,这是寡聚化所必需的,此外Bal-XL已显示出抑制NLRP1寡聚化的作用。因此,炎性胱天蛋白酶不能紧密贴近,这对caspase-1自身活化和促炎性细胞因子的后续加工产生了负面影响。除了那些潜在性NLRP1活性调节剂外,K+外流似乎对于NLRP1活化至关重要。
NLRP3/NALP3炎症小体
尽管NLRP3/NALP3炎症小体确切的活化机制仍然在争论中,但是研究者更偏向于以下三种模型:
1)NLRP3炎症小体激动剂的细胞外ATP与其受体P2X7结合,触发K+外流和pannexin-1膜孔形成。后者可以使细胞外因子进入细胞内,成为NLRP3的直接激动剂。NLRP3还可以感应K+外流或细胞膜完整性。
2)吞噬作用的结晶或颗粒状的NLRP3配体(如MSU、明矾、二氧化硅和石棉)后,由于机械性损伤引起溶酶体失稳和破裂,从而导致溶酶体内容物释放至细胞质中。由于该途径对组织蛋白酶B抑制剂CA-074-Me敏感,表明组织蛋白酶B(一种溶酶体蛋白酶)直接参与激活NLRP3配体。然而,在组织蛋白酶B缺陷的巨噬细胞中,并未发现响应NLRP3配体(如MSU或明矾)改变IL-1β分泌或caspase-1裂解。关于NLRP3如何感应细胞质溶酶体含量仍是未解之谜。
3)第三种模型涉及到了活性氧(ROS)的产生。所有测试的NLRP3激动剂都会导致ROS的产生,此外ROS清除剂会抑制NLRP3的活化。ROS的细胞来源目前仍未知,尽管ROS对于NLRP3炎症小体的活化似乎是必需的,但是还不足够。在B细胞中,已发现ROS敏感性NLRP3配体TXNIP(硫氧还蛋白互作蛋白;VDUP1)参与触发NLRP3活化。
与NLRP1一样,细胞质K+浓度似乎是NLRP3活化中的另一个重要参数。巨噬细胞在高钾浓度下培养表明,NLRP3依赖性caspase-1活化的降低可能意味着,NLRP3活化的上游需要K+外排。
IPAF炎症小体
IPAF炎症小体被功能性的T3SS或T4SS革兰阴性菌活化,如鼠伤寒沙门氏菌、福氏志贺氏菌、嗜肺军团菌和绿脓杆菌。最初的研究显示细胞质鞭毛蛋白会触发IPAF炎症小体活性。但是,无鞭毛细菌如福氏志贺氏菌,也会诱导IPAF炎症小体活化,因此很可能存在其他IPAF激动剂。在NLRP3的情况下,则显示IPAF与SGT1和HSP90结合。格尔德霉素对HSP90的抑制作用会阻断IPAF活性,表明HSP90在某种程度上对于IPAF信号传导很重要。不同于NLRP1和NLRP3,IPAF活化不受细胞外的高浓度K+抑制,这表明IPAF不是离子通量的传感器。然而,迄今仍未观察到直接的配体受体相互作用。
AIM2炎症小体
HIN-200家族成员AIM2充当细胞质细菌、病毒和宿主dsDNA的传感器,并通过形成AIM2炎症小体触发炎症反应。AIM2直接通过其C端HIN-200结构域与dsDNA结合。由于AIM2还识别宿主dsDNA,因此它可能与自身免疫性疾病有关。AIM2炎症小体的发现会如此引人注目不仅仅是因为AIM2是形成炎症小体的第一个非NLR家族成员,还因为AIM2是直接与其配体相互作用的第一个炎症小体受体。
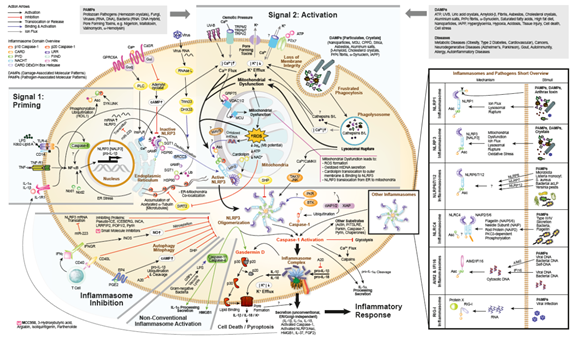
图3. 炎症小体信号
◆炎症小体检测
炎症小体是涉及生理和病理学炎症的多蛋白复合物。caspase-1的免疫印迹是检测炎症小体活化的金标准,但同时也存在一定的技术难题,特别是在蛋白质沉淀、蛋白质分离与转移方案的选择方面。致敏和激活步骤对于成功的免疫印迹来说也至关重要。下表是用于炎症小体检测的Adipogen公司标准抗体的一系列方法和规程:
anti-Caspase-1 (p20) (mouse), mAb (Casper-1) | 检测炎症小体 | ||
活性Caspase-1的免疫印迹 | |||
原发性鼠骨中的炎症小体激活和抑制 | |||
骨髓衍生细胞以及IL-1α,IL-1β和Caspase-1的测定 | |||
评估Caspase-1活化 | |||
anti-Caspase-1 (p10) (mouse), mAb (Casper-2) | 检测炎症小体 | ||
anti-Caspase-1 (p20) (human), mAb (Bally-1) | 检测炎症小体 | ||
anti-NLRP3/NALP3, mAb (Cryo-2) | 炎性小体激活的无细胞检测 | ||
检测NLR齐聚反应I:尺寸排阻色谱 | |||
免疫共沉淀和交联 | |||
HEK293细胞中NLR的功能重建 | |||
anti-Asc, pAb (AL177) | 检测响应细菌感染的炎症小体活化 | ||
检测NLR齐聚II:检测ASC斑点形成 | |||
通过共聚焦显微镜和免疫荧光 | |||
炎性小体活化的无细胞检测 | |||
anti-ZBP1, mAb (Zippy-1) | ZBP1/DAI is an innate sensor of influenza virus triggering the NLRP3 inflammasome and programmed cell death pathways: T. Kuriakose, et al.; Sci. Immunol. 1, aag2045 (2016) | ||
◆关键的炎症小体激动剂和抑制剂——包括新型Gasdermin抑制剂
产品列表
产品编号 | 产品名称 | 包装 | 产品描述 |
Monosodium urate (crystals) | 2 mg | 强力NLRP3炎症小体激动剂。 | |
2 mg×2 | |||
Monosodium urate [MSU] (ready-to-use) | 10 mg | ||
Nigericin . sodium salt | 5 mg | 强力NLRP3炎症小体激动剂。 | |
25 mg | |||
N-Acetyl-D-glucosamine | 250 mg | 通过从线粒体解离己糖激酶来充当NLRP3炎症小体的激动剂。 | |
1 g | |||
5 g | |||
Necrosulfonamide NEW! | 5 mg | 直接与Gasdermin D结合以抑制N末端的寡聚化, | |
25 mg | |||
U-73122 NEW! | 1 mg | Gasdermin D N末端片段(GSDMD-N)诱导的凋亡抑制剂。 | |
5 mg | |||
MCC950 . Na | 1 mg | 强力的靶向性NLRP3炎症小体抑制剂。 | |
5 mg | |||
10 mg | |||
Isoliquiritigenin | 10 mg | 抑制NLRP3活化的Asc寡聚化。 | |
50 mg | |||
BAY 11-7082 | 10 mg | 降低NLRP3炎症小体的ATPase活性。 | |
50 mg | |||
(R)-3-Hydroxybutyric acid | 25 mg | 防止K+外流,从而减少Asc寡聚化和颗粒形成。 | |
100 mg | |||
(S)-3-Hydroxybutyric acid | 25 mg | ||
100 mg | |||
DL-3-Hydroxybutyric acid sodium salt | 1 g | ||
10 g | |||
K777 [K11777] NEW! 半胱氨酸蛋白酶抑制剂 | 1 mg | 可用于抑制炎症小体的广域组织蛋白酶抑制剂。 | |
5 mg |
◆NLRP3炎症小体的预激活
NLRP3炎症小体的最突出的功能是促白细胞介素-1β前体(pro-IL-1β)的加工和活化。然而,大多数细胞不表达pro-IL-1β,因此需要先激活pro-IL-1β的表达。这可以通过刺激受体如TLRs(如通过LPS)、Nods、tNF-Rs(如通过TNF-α)或IL-1R1(通过IL-1α和IL-1β)激活NF-κB并启动pro-IL-1β转录。这种pro-IL-1β诱导过程称为致敏(priming)(第1个信号)。Priming还诱导NlRP3的NF-κB依赖性转录。
查看用于炎症小体预激活的即用型LPS溶液
无需为LPS溶解烦恼,请选择使用AdipoGen Life Science的即用型LPS溶液
产品列表
产品编号 | 产品名称 | 包装 |
Kdo2-Lipid A (ready-to-use) (THE STANDARD) | 1 mg | |
LPS (Universal) from S. abortus equi (S-form) TLRpure™ Sterile Solution (THE STANDARD) 脂多糖(通用)来源于马流产沙门氏菌(S-form) TLRpure™ 无菌溶液 | 500 μg | |
1 mg | ||
1 mg×5 | ||
LPS from E. coli R515 (Re) TLRpure™ Sterile Solution (THE STANDARD) 脂多糖来源于大肠杆菌 R515(Re)TLRpure™ 无菌溶液 | 500 μg | |
1 mg | ||
1 mg×5 | ||
LPS from E. coli O8:K27 (S-form) TLRpure™ Sterile Solution | 500 μg | |
1 mg | ||
1 mg×5 | ||
LPS from S. minnesota R345 (Rb) TLRpure™ Sterile Solution | 500 μg | |
1 mg | ||
1 mg×5 | ||
LPS from S. minnesota R595 (Re) TLRpure™ Sterile Solution | 500 μg | |
1 mg | ||
1 mg×5 |
查看我们的炎症小体预激活TNF-α蛋白
产品列表
产品编号 | 产品名称 | 包装 |
TNF-alpha, Soluble (human) (rec.) | 10 μg | |
50 μg | ||
50 μg×3 | ||
TNF-alpha (human) (multimeric) (rec.) | 10 μg×3 | |
10 μg | ||
TNF-alpha (mouse) (multimeric) (rec.) | 10 μg | |
10 μg×3 |