产品中心
技术交流

扫描二维码
逐典分享丨质量源于设计,赋能 RNA 平台生产工艺
基于 RNA 的产品已成为全球疫苗接种、传染病控制和未来疗法开发最有前途和战略性的技术之一。对关键质量属性 (CQA)、产品-工艺相互作用、相关过程分析技术以及过程建模能力的评估可以为未来的开发、设计和生产过程控制提供强大的质量源于设计 (QbD) 框架。QbD 的实施将帮助 RNA 技术充分发挥其潜力,并将成为快速响应、与疾病无关的 RNA 平台化生产工艺的开发、资格预审和监管批准的核心。
RNA生产的前景和挑战
COVID-19大流行和安全高效的 RNA 疫苗的出现将 RNA 技术带到了医学创新的前沿。快速的开发和生产时间表,结合最近的基因分型方法,使RNA 技术适用于应对新出现的传染性威胁和变异株。大多数常规疫苗和生物药需要使用具有固有可变性的细胞培养技术,而 RNA 生产基于相对简单、可放大且价格合理的无细胞生产系统。鉴于其作用机制,RNA 技术的治疗范围很广,生产过程也多种多样(框 1)。潜在的临床应用包括传染病预防;罕见病治疗;以及基因、肿瘤和蛋白质替代疗法。不同的产品可以使用相同的原材料(不包括 DNA 模板)、耗材、设备、单元操作和分析方法来生产。然而,多产品平台技术仍然需要科学和工业界的证明,才能获得批准并真正具有颠覆性。
目前基于 RNA 的药物产品
基于 RNA 的疫苗和治疗药物由两个关键要素组成:编码目标蛋白质的 RNA 活性物质以及作为递送载体的 LNP 结构。通常,该蛋白质可以是病毒抗原,例如 SARS-CoV-2 刺突蛋白、肿瘤标志物或缺失的蛋白质。无论给药途径如何,RNA 通过受体介导的机制进入细胞质。然后,mRNA 活性物质使用宿主细胞翻译机制,而 saRNA 也编码自己的复制机制。这是这两类基于 RNA 的产品之间的主要区别之一。目前,已批准的疫苗和大多数处于临床阶段的候选疫苗都基于非复制 mRNA 系统。然而,saRNA 可能是更有利的选择,因为较低剂量的 RNA 可能足以增强和延长蛋白质表达,从而降低生产成本以及一些不良反应的发生。当然,saRNA核苷酸序列也更长(大约 10 kb vs. mRNA COVID-19 疫苗的 4.5 kb),这意味着潜在的生产差异。在本文中,mRNA 和 saRNA 系统统称为“RNA 技术”。
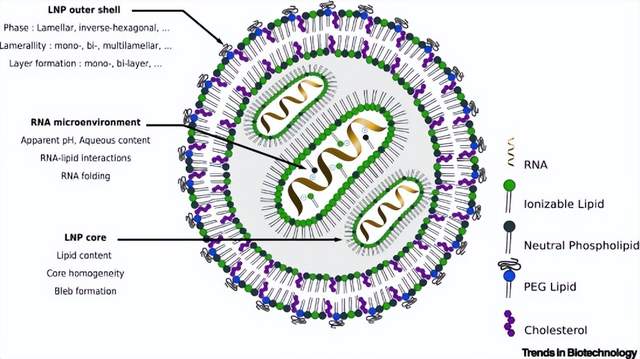
RNA-LNP 系统的假设结构
图示的 LNP 是内核致密的单层纳米颗粒,具有双层外膜。基于脂质类型和相关的生产过程,可能存在多种结构模型。RNA 微环境、LNP 形态、层状、外壳和核心结构可能因不同的 LNP 制剂而有差异。目前,LNP 代表了最合适的递送系统,并被3家最先进的公司用于其 COVID-19 mRNA 疫苗:Moderna、BioNTech 和 CureVac。最近的研究进一步确定其对于saRNA活性药物底物优于基于聚合物的递送系统。最先进的 LNP 由4种不同的脂质组成:中性磷脂、PEG 脂质、胆固醇和可电离脂质(图 I)。
PEG 脂质在 LNP 结构中起着关键作用,并且是防止 LNP 聚集的空间屏障。可电离脂质含有胺基,在酸性 pH 下带正电荷,从而与 RNA 载荷相互作用并在混合过程中简化其封装。这些脂质也是确定 LNP 融合性和循环特性的基础。最后,磷脂和胆固醇是 LNP 结构的基础。此外,LNP 专利格局复杂,涉及大量专利许可和法律诉讼。这是 LNP 在脂质组成和生产工艺方面存在多样化的原因之一。
此外,只有在承担着高风险的融资策略、政府支持和对工业改变的强烈激励下,才能快速生产安全高效的疫苗。从长远来看,这种方法既不可持续也不可取。迫切需要国际技术转移和分布式生产。此外,尽管在这些获批的疫苗中观察到了高水平的安全性和有效性,产品质量仍然是一个关键问题。一个例子是罕见的严重不良事件的发生,例如心肌炎和过敏反应,这可能会阻碍疫苗接种活动并加重公众对这项新技术的不信任。它们的临床成功不应掩盖当前对加强针的需求和其它 mRNA 候选疫苗的失败。RNA 活性物质和脂质纳米颗粒 (LNP) 这两种成分都不稳定且易于降解。例如,BNT162b2 疫苗中的 RNA 完整性估计在生产结束时约为 70%,预计在分发过程中会进一步降解。这部分反映在产品储存的低温要求上,这进一步使疫苗供应链复杂化。
最后,RNA 技术仍处于紧张发展阶段,应在临床试验中证明其治疗多功能性,同时预计会有新的生产要求。因此,面对这些多重挑战,似乎有必要对产品和工艺进行更深入的了解。缺乏严格的、专门针对 RNA的监管指南为持续创新留下了进一步的空间。特别是,将 QbD 方法应用于这类新药物可能是一种范式转变,并可能释放 RNA 生产技术的潜力。
本文将讨论如何调整这些 QbD 原则并将其应用于基于 RNA 的产品,以及这项新技术将如何从中受益。本文将分析这一快速发展领域的新文献,并通过多产品和以患者为中心的生产方法进行了解释。对现有知识的回顾将提供对产品质量属性、过程参数及其潜在相互作用的第一次基于风险的审查。由此,可以确定开发表征和建模工具、以支持增强的 QbD 方法的潜在途径。最终,可以得出一个理论和整体的生产框架,包括并整合 CQA、关键工艺参数 (CPP) 以及当前和未来基于 RNA 的产品的要求。在开发的早期阶段,该分析将进一步为快速部署多功能、分布式和负担得起的 RNA 平台技术带来新的视角和路线图。

质量源于数字设计的迭代循环开发
质量源于设计 (QbD) 的兴起源于认为增加检测不足以提高产品质量的观点。相反,QbD强调应该通过对产品和过程的深入理解,将质量构建到产品中。更准确地说,产品质量需要与临床和非临床研究联系起来,以确保药物的安全性和有效性。生产过程的设计应减少产品可变性并提高工艺能力。此外,增强的知识应该能够实现有效的规模放大、批准后的变更和根本原因分析。在实践中,QbD 开发始于 (1) 识别患者需求和建立质量目标产品属性 (QTPP)。(2) 在此基础上,建立关键质量属性 (CQA) 和相关验收标准的列表。(3,4) 然后使用先验知识来识别每个工艺步骤的工艺参数 (PP) 和关键工艺参数 (CPP)。(5) 基于产品过程知识,努力建立可靠和准确的数学模型,将 CQA 与 CPP 联系起来。
(6) 这些模型可用于识别过程设计空间并支持同步进行产品和工艺开发。(7) 当获得的知识用于设计过程控制策略时,QbD 开发达到高潮。第一种方法是通过使用可靠的设计空间和识别影响 CQA 的所有过程可变性来源,来简单地减少对大量产品检测的需求。工艺参数不受拘谨的限制,产品属性更加一致。过程控制通常也被转移到上游。(8) 第二种更雄心勃勃的 QbD 方法是使用数学建模,进行高级预测控制和实时过程优化。一旦该方法经过测试和验证,其实施就可以提高质量保证水平,并实现实时放行检测、过程自动化和数字化。QbD 框架开发遵循一个迭代循环,因为数学建模、分析和实时检测可用于重新评估参数的关键性并制定适当的生命周期管理策略。当获得的知识从一种产品/工艺转移到另一种产品/工艺时,QbD 尤其强大,从这个意义上说,它在平台技术中非常有前途。
在 QbD 框架下识别 CQA
在 QbD 中,CQA 是生产工艺开发、设计、监测、控制和生命周期管理的基础。表 1 给出了基于 RNA 的生物药的潜在CQA 的首次全面鉴定。它建立在先验知识、当前结构-功能理解、非临床研究和相关现实世界经验的基础上。此外,该列表符合新的和现有的监管指南,并包含 mRNA-1713 和 BNT162b2 产品的规格。每个属性的来源、风险评估方法和详细原理显示在在线补充信息的表 S1-S3 中。
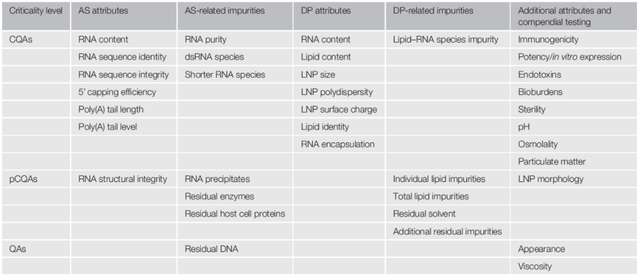
RNA产品质量属性的识别
更具体地说,先天免疫系统的激活是评估基于 RNA 的生物制品安全性和有效性的核心因素。炎症反应确实与最常见和罕见的不良事件有关。虽然免疫原性可以先验地被认为是产品功效的一个有利特征,提供类似佐剂的特性,但由于应激基因的激活以及先天免疫和翻译机制之间的细胞权衡,它可以同时减少 RNA 翻译。尽管最小化炎症似乎成为预防性疫苗的最佳方法和基因治疗的要求,但这种刺激在肿瘤治疗中仍然很有希望,因为 I 型干扰素激活与有利的疾病结果相关。更间接地来看,炎症可以通过限制剂量方案来影响效力,正如 CureVac 的 COVID-19 疫苗试验的II期发生的那样。
关于药物产品,裸 RNA 和空 LNP 的体内给药会触发免疫刺激,证实了这两种结构的免疫原性。应特别强调与观察到的过敏反应有关的聚乙二醇 (PEG) 脂质。一方面,潜在的脂质-RNA 反应和杂合也需要仔细考虑,因为它们已在 mRNA-1713 生产过程中观察到,并可能导致活性物质效力的失活和提高的降解。另一方面,许多与 RNA 相关的杂质也具有潜在的免疫原性(表 1),较长的双链 RNA (dsRNA) 物质代表了主要风险之一。这些异质性副产物是高效的病原体相关分子模式,可以完全阻碍 RNA 翻译。结构元素,如 5'-帽和多腺苷酸化 [poly(A)] 尾,以及它们的完整性在产物反应原性和翻译效率中起着另一个关键作用。
虽然 RNA 一级序列的重要性是显而易见的,但 RNA 二级和三级结构的重要性也在评估中。BNT162b2 活性物质的高阶结构已在表征研究中进行了评估,预计会影响 RNA 热稳定性和半衰期。最终,LNP 结构特征,如脂质含量、粒径分布和表面电荷,对于确定免疫原性、生物分布、细胞摄取、内体逃逸和循环时间至关重要。
尽管现在已经彻底确定了风险,但我们对产品结构、炎症途径及其与临床表现的联系的理解仍存在重大知识空白。首先,如框 1 所述,已观察到可能影响产品活性的 LNP 结构和形态特征的多样性,但在开发过程中很少对其进行测试或筛选。一旦更好地理解,LNP 形态的一致性也可以在初始工艺开发、规模放大或技术转移期间进行检查。其次,阐明某些炎症通路的激活,包括在靶效应和脱靶效应,将有助于优化安全性和有效性。例如,RNA 疫苗的临床研究告诉我们,Th1 型偏倚反应和特定的细胞因子特征可能是有效抗体反应的预测因子。这也将帮助我们定义适当的端点并设计相关的模型和分析测试,这仍然是当前工艺开发和质量控制策略的基础。最后,随着 RNA 技术范围的扩大,确定特定给药途径、治疗领域或靶向器官的最佳产品特性将至关重要。
虽然最佳免疫原性谱和 LNP 形态都可能高度可变,但其它 CQA 的目标也可能不同。其中,虽然当前 RNA 疫苗需要中性颗粒表面,但表面电荷似乎是器官靶向和确定淋巴结和粘液穿透能力的关键参数。此外,LNP 分子组成和大小在产品的生物分布和活性中都发挥着明显的作用。而且,所需的活性物质的免疫原性也可以变化。这在重复 RNA 给药或高剂量方案的情况下尤其重要,例如长期给药或蛋白质替代疗法。总之,解决这些问题可能会重塑未来的产品和工艺开发。
来源:生物工艺与技术
* 推文用于传递知识,如有版权等疑问,请联系我们。