产品中心
技术交流

扫描二维码
5条肿瘤代谢通路
以下文章来源于闲谈 Immunology ,作者谷语
即使在氧充分的条件下(有氧糖酵解/Warburg效应),癌细胞上调葡萄糖的糖酵解途径形成乳酸,这个过程被认为是恶性肿瘤的标志。代谢活跃的癌细胞导致营养消耗、缺氧、酸性、有毒的代谢物富集的肿瘤微环境,抑制免疫系统。
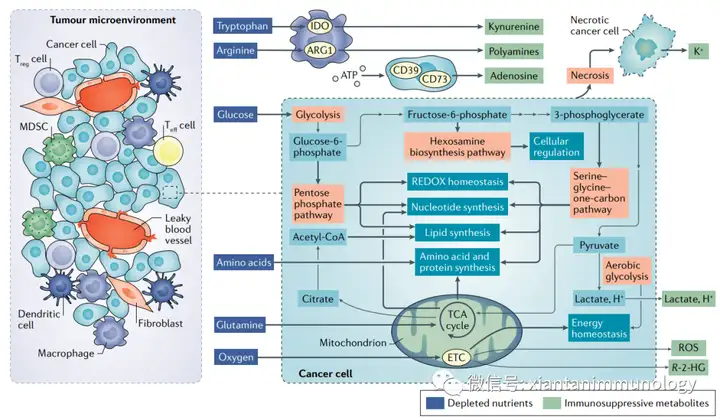
肿瘤细胞代谢与肿瘤微环境(Nat Rev Cancer . 2020 Sep;20(9):516-531)
Hippo Pathway Hippo通路控制细胞增殖、器官大小和组织稳态。它由MAPK家族、MST1/2、LATS1/2以及转录共激活因子YAP和TAZ组成。 当该通路被激活时,上游信号磷酸化并激活MST1/2和LATS1/2,从而磷酸化YAP/TAZ。因此,YAP/TAZ通过14-3-3蛋白被隔离在细胞质中,并被E3连接酶β-TRCP降解。
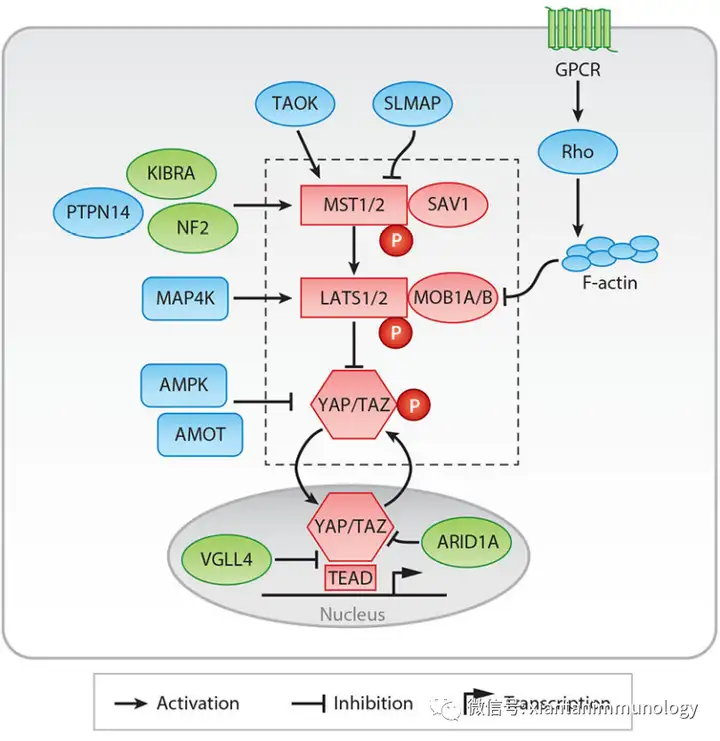
Annu Rev Pathol. 2021 January 24; 16: 299–322
然而,当Hippo信号通路关闭时,YAP/TAZ易位到细胞核,与转录增强相关域(TEAD)转录因子结合,诱导致癌靶基因的表达。
Hippo通路受到广泛的上游调控因子的调控,包括细胞-细胞接触、来自周围环境刺激、Wnt信号传导、GPCR-配体相互作用和各种细胞应激条件。
YAP/TAZ促进糖酵解和谷氨酸代谢
YAP/TAZ活性在许多类型的癌症中都是过度活跃。hHippo通路作为细胞生长的主调节因子,参与了多种代谢过程。YAP/TAZ活性通过直接和间接提高糖酵解酶活性来促进糖酵解。特别是,YAP/TAZ的活性增加了TEAD对GLUT3的表达,并通过FOXC2诱导了HK2的表达。YAP/TAZ还通过Hedgehog信号通路促进LncRNABCAR4的表达,上调HK2和PFKFB3。YAP/TAZ增强谷氨酰胺代谢,增加乳腺癌细胞中谷氨酰胺转运体SLC1A5和SLC7A5的表达。YAP/TAZ和TEAD通过表达氨基酸转运体上调谷氨酰胺和氨基酸代谢。YAP/TAZ诱导谷氨酰胺酶和转氨酶的表达,包括GOT1和PSAT1,它们产生NEAAs和TCA循环中间体。YAP/TAZ积累脂质,直接调节胆汁酸成分,从而增强癌细胞的转移潜能。
葡萄糖增强YAP/TAZ的活性
细胞周期进程和细胞增殖由营养物质浓度决定。葡萄糖代谢对YAP/TAZ活性有显著影响。高糖水平增加了HSP的葡萄糖通量,产生用于糖基化的UDP-GlcNAc。因此,丰富的葡萄糖诱导YAP O-GlcNAcylation,干扰LATS和βTrCP的相互作用,进而增强YAP/TAZ的活性。在胰腺癌和肝癌中,YAP被O-GlcNAcylation过度激活。
LATS2的糖基化通过干扰乳腺癌中LATS2和MOB1的相互作用来抑制其活性。相反,葡萄糖剥夺诱导的能量应激通过hippo依赖和非依赖的机制抑制YAP/TAZ活性。能量传感器AMPK随着ATP的减少而被激活。AMPK直接磷酸化YAP的丝氨酸61和丝氨酸94,从而阻断YAP-TEAD的相互作用。AMPK通过AMOTL1磷酸化和激活间接抑制YAP。外部激素水平可以调节Hippo通路。脂质激素,如溶血磷脂酸和鞘氨醇-1-磷酸,通过GPCRs抑制该通路,肽激素胰高血糖素增加血糖水平,通过cAMP和PKA激活Hippo通路。
脂肪增强YAP/TAZ的活性
亚细胞脂质成分也可以调节Hippo通路激酶。SREBP是Hippo通路的上游调控因子。当SREBP被激活时,甲羟戊酸途径增强了RhoAGTPase的香叶酰化。RhoA是一个f-actin的细胞骨架调节因子,而f-actin是一个成熟的LATS激酶的上游因子。因此,癌细胞中脂肪酸代谢的增加会异常激活RhoA,并通过抑制LATS来增强YAP/TAZ的活性。有趣的是,YAP/TAZ在血液系统恶性肿瘤中几乎不表达,而YAP的强制表达已被证明可以介导肿瘤抑制功能。
PI3K-AKT/mTOR Pathway
在正常细胞中,细胞的增殖和合成代谢受到外部生长因子(如胰岛素和激素)的微妙调节,PI3K-AKT-mTOR通路是其中一条重要通路。 PI3K/AKT信号通路调节代谢酶。在被胰岛素激活后,AKT通过磷酸化GSK3来抑制糖原合成途径。PI3K/AKT通过代谢酶的翻译后修饰(如磷酸化、糖基化)直接或间接上调糖酵解。例如,AKT磷酸化并激活AS160蛋白,从而增强了GLUT的膜运输。AKT通过抑制磷酸化直接抑制TXNIP,通过抑制内吞作用增加GLUT1/4的膜表达。 AKT还提高了糖酵解酶的效率。AKT通过增加HK2的线粒体整合来磷酸化并激活HK2。AKT使PFKFB磷酸化;这种变化催化果糖-6-磷酸到F-2,6-BP,从而提高糖酵解。AKT信号通路也通过HIF-1α转录因子促进糖酵解。HIF-1激活一些糖酵解组分,包括GLUT。HIF-1诱导LDH促进乳酸分泌和有氧糖酵解。 PI3K/AKT信号通路上调谷氨酰胺和脂肪酸代谢。AKT通过mTORC1增加Myc的翻译,并通过GSK3和FOXO3A抑制Myc的降解。由于MYC调节谷氨酰胺代谢,MYC的激活增加了细胞氮的供应。因此,AKT促进了核苷酸的合成。癌细胞需要从头脂质合成来维持和供应持续的无限细胞分裂所需的膜成分。AKT通过直接磷酸化脂质合成的第一个酶ACLY,影响脂质的新生生物合成过程,从而提高酶的效率。AKT通过ACLY调控增加各种癌症类型中的组蛋白乙酰化 AKT诱导的mTORC1激活增强了SREBP家族的翻译和切割加工。AKT介导的GSK3抑制进一步阻止了SREBP1的降解。因此,了解通过PI3K/AKT信号通路的代谢重编程将阐明PI3K抑制剂对癌症治疗的有效治疗替代方案。
Myc Pathway
转录因子c-Myc通过MAX调控基因表达,是癌细胞中最过度活跃的基因之一,位于生长相关信号通路(如EGFR、AKT和GPCRs)的交叉点。
Myc调节与葡萄糖、谷氨酰胺和脂肪酸代谢相关的基因的表达。Myc通过上调糖酵解和谷氨酰胺水解来增强癌细胞的代谢重。Myc诱导许多糖酵解酶(如GLUT、HK2和PFK),它们催化糖酵解过程相应步骤。
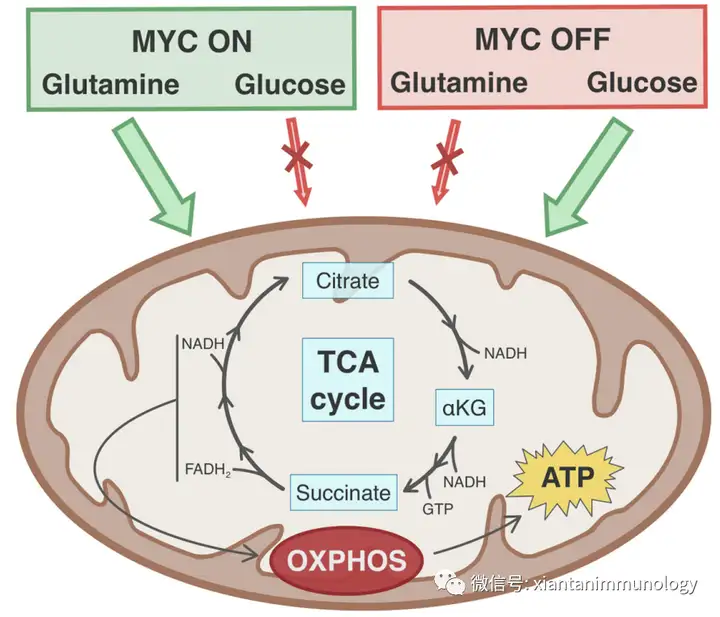
MYC癌基因的激活驱动谷氨酰胺的优先代谢向TCA循环添补反应(Anaplerosis)和随后的氧化磷酸化。MYC癌基因表达的缺失增加了线粒体代谢对葡萄糖的依赖。
p53 Pathway
P53是最著名的肿瘤抑制基因之一,它影响细胞过程,包括凋亡、细胞周期进程和代谢。p53在细胞应激条件下被激活,如DNA损伤和营养剥夺。根据应激源的类型和强度,它决定了是发生适应还是细胞死亡。p53在转录、翻译和翻译后水平上被调节。p53的稳定性受E3连接酶MDM2的调控。
AMPK磷酸化,乙酰化,从而在能量应激条件下稳定p53。通过上调MDM2来促进p53的降解,p53诱导一个负反馈回路来维持稳态。
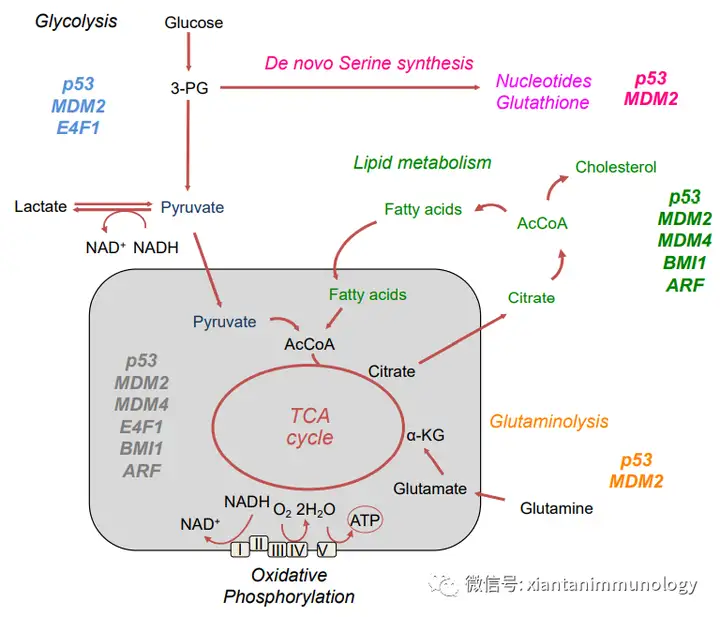
p53调节代谢(Cancers 2021, 13, 133)P53减少有氧糖酵解,上调线粒体分解代谢过程,包括脂肪酸氧化(FAO)和OXPHOS;p53转录抑制GLUT1和GLUT4的表达,抑制葡萄糖摄取;抑制TCA循环;增加脂肪酸氧化;增加氧化磷酸化(OXPHOS),积累NADH和FADH2。
5. LKB1/AMPK Pathway
AMPK是一种保守性良好的能量传感激酶。AMPK抑制合成代谢途径(脂肪酸合成、mTOR途径),促进分解代谢(糖酵解、Krebs循环、磷酸戊糖途径、脂肪酸氧化和自噬)的细胞过程。因此,AMPK的激活允许细胞承受细胞能量应激条件。
与其他代谢蛋白不同,AMPK的调控依赖于AMP和ADP的细胞浓度,但独立于其他代谢中间体。AMP/ATP比值的增加导致AMP相互作用,随后是AMPK的构象变化。在癌症的背景下,应激环境下的AMPK激活,包括缺氧和能量或营养剥夺,赋予了各种癌症的应激抵抗特性。
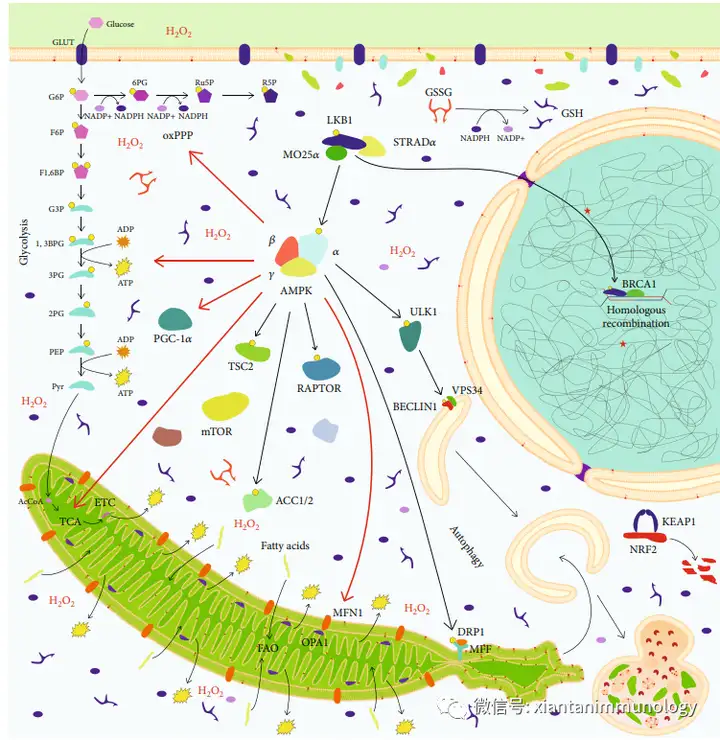
*红色箭头(激活上调)(Oxid Med Cell Longev . 2019 Oct 31;2019:8730816.)
AMPK是一种致癌蛋白还是肿瘤抑制蛋白仍有待确定。在临床环境中,AMPK激活剂,包括2型糖尿病药物二甲双胍和AICAR,被用于抑制癌细胞增殖;然而,AMPK也通过促进原蛋白抗性、迁移和转移作为致癌蛋白。 ACC是AMPK的一个成熟的靶点。ACC在脂肪酸从头合成过程中,ACC介导乙酰辅酶A转化为丙二酰辅酶A。AMPK通过抑制ACC磷酸化来减少ATP的消耗。AMPK降低的脂肪酸合成通量降低了NADPH的消耗。为了满足细胞对脂质代谢物的需求,AMPK通过CD36和其他脂质转运体上调脂肪酸的摄取来维持脂质稳态。
蛋白质翻译是高度耗能的,并使用多种合成代谢途径,包括PPP和谷氨酰胺水解。AMPK通过抑制mTORC1和翻译机制,允许癌细胞适应恶劣的营养条件,如葡萄糖剥夺。
主要参考文献
Jordan H. Driskill et al,The Hippo Pathway in Liver Homeostasis and Pathophysiology. Annu Rev Pathol. 2021 January 24; 16: 299–322
Robert D. Leone and Jonathan D. Powell, Metabolism of immune cells in cancer, Nat Rev Cancer . 2020 Sep;20(9):516-531
Tambay, V.; Raymond, V.-A.; Bilodeau, M. MYC Rules: Leading Glutamine Metabolism toward a Distinct Cancer Cell Phenotype. Cancers 2021, 13, 4484: Lahalle, A.; Lacroix, M.; De Blasio, C.; Cissé, M.Y.; Linares, L.K.; Le Cam, L. The p53 Pathway and Metabolism: The Tree That Hides the Forest. Cancers 2021, 13, 133
Francesco Ciccarese et al. LKB1/AMPK Pathway and Drug Response in Cancer: A Therapeutic Perspective,Oxid Med Cell Longev . 2019 Oct 31;2019:8730816.
【关于逐典】
上海逐典生物科技有限公司,坐落于中国(上海)自由贸易试验区,获得ISO9001质量体系认证,是一家从事重组蛋白研发和销售的高新科技企业。
逐典生物始终秉持以客户为中心的理念,针对重组蛋白的结构设计、纯化工艺及其稳定剂型相关的多项关键技术进行优化。专业定向蛋白变复性技术,可将大肠杆菌大量表达的变性固体蛋白转变成高活性可溶性蛋白。凭借技术优势,逐典生物新品研发周期短且可控性强,为重组蛋白的高质高效研发提供保障,为企业生产降本增效。
公司自成立以来成功开发百余种高活性细胞因子及多种高活性蛋白酶,覆盖细胞培养、病毒纯化以及质量分析等生物工艺各个环节。可广泛应用于科研、医药生产及IVD(体外诊断试剂)等领域,满足各类用户所需。
