产品中心
技术交流

扫描二维码
10月综述:CAR-T 和 CAR-NK 作为实体瘤的细胞癌免疫疗法
以下文章来源于Of Studies ,作者Of studies
在过去的十年中,嵌合抗原受体T细胞疗法已成为抗击癌症的一种极有前景的免疫治疗方法,对儿童和成人的复发/难治性血液系统恶性肿瘤表现出显著的疗效。CAR自然杀伤(CAR-NK)细胞补充了CAR-T细胞疗法,提供了几个独特的优势。CAR-NK细胞不需要HLA兼容性,并且表现出较低的安全性问题。此外,CAR-NK细胞有利于“现货”治疗,有比CAR-T细胞更方便的物流优势。CAR-T和CAR-NK细胞在血液系统恶性肿瘤中均显示出一致和有希望的结果。
然而,对实体瘤的疗效均受到诸多限制,原因包括有限的肿瘤迁移和浸润,以及免疫抑制性肿瘤微环境。
这篇综述讨论了CAR-T和CAR-NK细胞免疫疗法的最新进展和当前挑战,特别关注它们在实体瘤应用中的障碍。并深入分析了CAR-NK细胞与CAR-T细胞相比的优势和缺点,并强调了CAR-NK的CAR优化。
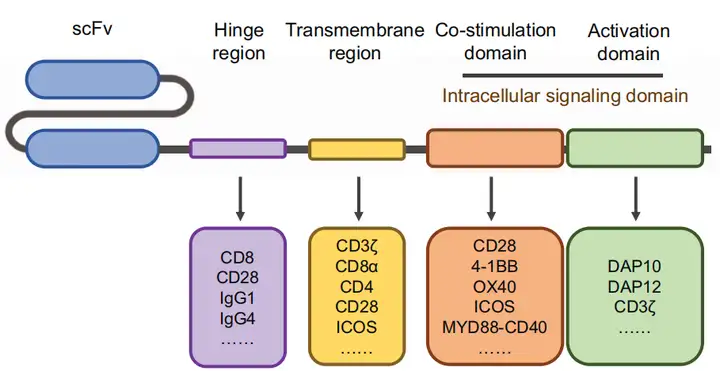
1、CAR的结构
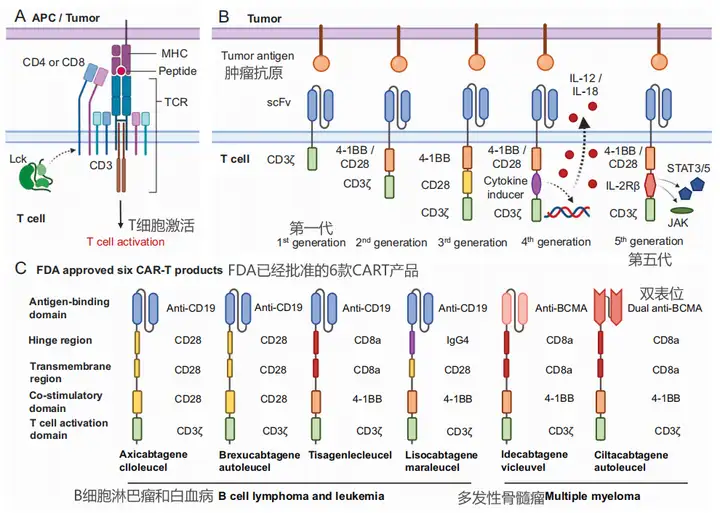
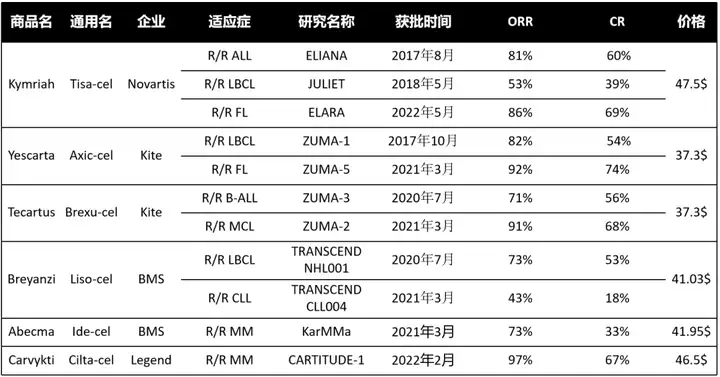
6款产品有效性如下
根据不同的设计理念和结构组成,CAR可以分为五代:
第一代CAR(1st generation CAR):主要由单链可变片段(scFv)构成的抗原结合域和CD3ζ链构成的T细胞激活域组成。这些CAR的设计相对简单,能够使T细胞识别特定的肿瘤抗原,并通过CD3ζ链直接激活T细胞。第一代CAR-T细胞在临床试验中显示出有限的增殖、植入和细胞毒性,导致临床效果不佳。
第二代CAR(2nd generation CAR):在第一代的基础上增加了共刺激信号域,如4-1BB或CD28信号域,以增强T细胞的激活和增殖。这些共刺激信号域能够提供额外的信号,从而改善CAR-T细胞的持久性和效力。
第三代CAR(3rd generation CAR):结合了第二代CAR的特点,同时包含4-1BB和CD28两个共刺激信号域。这种设计旨在进一步增强CAR-T细胞的活性和功能,提高其对肿瘤细胞的杀伤能力。
第四代CAR(4th generation CAR):结合前三代特点,不仅能够识别和杀死肿瘤细胞,还能分泌细胞因子,如IL-12,以增强局部的免疫反应。这种CAR设计旨在通过分泌细胞因子来激活和招募更多的免疫细胞参与抗肿瘤反应。
第五代CAR(5th generation CAR):第五代CAR-T细胞的设计更加复杂,可能包括多个细胞因子的共表达,或者结合了特定的免疫调节策略,如PD-1/PD-L1的阻断。这些CAR-T细胞旨在通过多种机制增强T细胞的抗肿瘤活性,同时减少T细胞耗竭和提高T细胞在肿瘤微环境中的存活率。
每一代CAR的设计都旨在解决前一代CAR在临床应用中遇到的问题,如持久性、疗效和安全性等。随着研究的深入和技术的进步,CAR-T和CAR-NK细胞疗法正在不断发展,以提高对癌症的治疗效果。
2、CAR-T面临的挑战和攻克实体瘤的工程策略
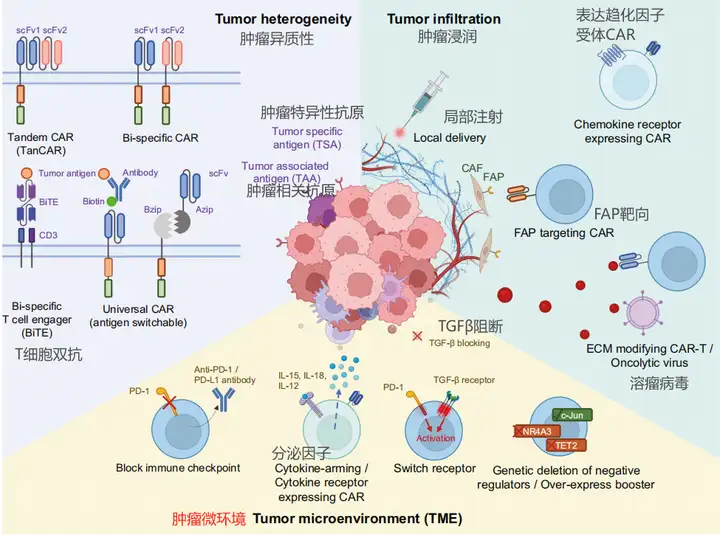
CAR-T细胞疗法在治疗实体瘤方面面临多重挑战,主要包括以下几点:
1.肿瘤异质性(Tumor Heterogeneity):实体瘤内部存在高度的异质性,肿瘤细胞可能表达不同的抗原,使得单一靶向策略容易因抗原逃逸而失败。
2.肿瘤浸润和渗透(Tumor Infiltration):实体瘤的微环境,包括纤维化基质和异常血管,构成了物理屏障,阻碍CAR-T细胞的浸润和渗透。
3.免疫抑制性肿瘤微环境(Immuno-Suppressive TME):实体瘤微环境中存在多种免疫抑制性细胞和因子,如调节性T细胞(Tregs)、骨髓源抑制细胞(MDSCs)以及免疫抑制配体和因子(如PD-L1、TGF-β和腺苷),这些因素抑制CAR-T细胞的活性、增殖和持久性。
为了克服这些挑战,研究人员开发了多种工程策略:
1.多靶点靶向策略(Multi-Targeting Strategies):通过组合不同CAR-T细胞产品或开发能够同时识别多个抗原的CAR-T细胞(如双特异性CAR或TanCAR),来减少抗原逃逸现象。
2.增强CAR-T细胞的迁移和浸润(Enhancing Trafficking and Infiltration):通过基因工程改造CAR-T细胞,使其表达特定的趋化因子受体,如CXCR4、CCR4或CCR2b,以增强其向肿瘤组织的迁移能力。
3.阻断免疫检查点(Blocking Immune Checkpoints):通过基因编辑或共给予免疫检查点抑制剂(如抗PD-1/PD-L1抗体),来逆转CAR-T细胞的功能障碍。
4.增强CAR-T细胞的抗肿瘤功能(Enhancing Anti-Tumor Function):通过共刺激信号域的优化、分泌刺激性细胞因子(如IL-12、IL-18或IL-15)或调节T细胞内源性遗传调节因子,来增强CAR-T细胞的抗肿瘤活性。
5.提高临床安全性(Improving Clinical Safety):通过引入“自杀基因”或开发可切换的CAR-T细胞,以减少细胞因子释放综合征(CRS)和神经毒性等严重副作用。
这些策略的发展和应用有望提高CAR-T细胞疗法在实体瘤治疗中的有效性和安全性。
3、评价CAR-NK细胞疗法的代表性临床试验
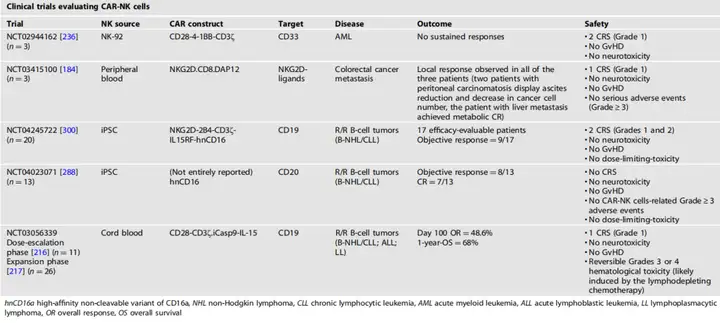
4、改善CAR-NK细胞治疗实体瘤的当前挑战和持续策略
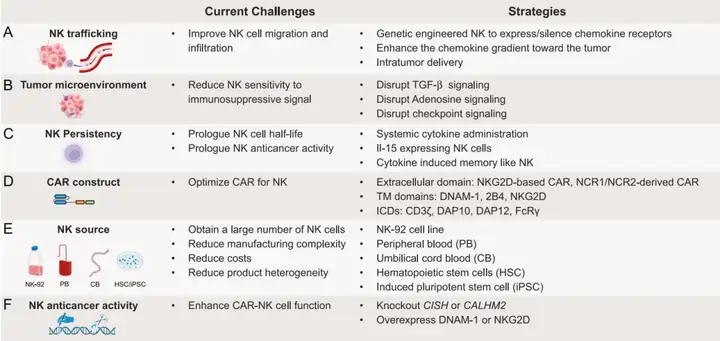
A.细胞迁移(Cell Trafficking):CAR-NK细胞在有效靶向实体瘤时面临的一个主要挑战是细胞迁移能力。图中可能展示了不同的策略,比如通过基因工程改造CAR-NK细胞以表达特定的趋化因子受体,增强其向肿瘤组织的迁移能力。
B.肿瘤微环境(Tumor Microenvironment, TME):实体瘤的微环境对NK细胞功能有抑制作用。图中可能描述了如何通过药理学抑制或基因工程手段来克服TME中的免疫抑制因素,例如通过抑制TGF-β或通过基因编辑减少免疫抑制细胞的影响。
C.NK细胞的持久性(NK Cell Persistence):NK细胞在体内的持久性较短,这对于CAR-NK细胞治疗是一个挑战。图中展示了如何通过基因工程改造CAR-NK细胞,如使其表达IL-15等细胞因子,以增强其在体内的持久性和抗肿瘤活性。
D.CAR构建的优化(Optimizing CAR Constructs):展示了针对NK细胞信号传导优化的CAR构建,包括不同的胞外scFv结构域、跨膜区和胞内共刺激域的选择,以提高CAR-NK细胞的疗效。
E.不同的NK细胞来源(Different Sources of NK Cells):讨论了不同的NK细胞来源,包括NK-92细胞系、外周血、脐带血、造血干细胞和诱导多能干细胞(iPSC),以及这些来源的优缺点。
F.增强CAR-NK细胞功能的替代策略(Alternative Strategies for Enhancing CAR-NK Cell Function):通过基因编辑技术增强NK细胞的抗肿瘤活性,例如通过CRISPR技术敲除特定的抑制基因或过表达增强NK细胞活性的基因。
5、CAR-NK结构设计与优化蓝图
6、CAR-T和CAR-NK细胞的优势和局限性

优势:
长期肿瘤控制:CAR-T细胞能够提供长期的肿瘤控制能力,因为它们可以长期存在于体内并持续对肿瘤细胞进行监控和攻击。
个性化治疗:CAR-T细胞通常来源于患者自身(自体)的T细胞,这意味着它们可以被设计为特异性识别患者肿瘤上的特定抗原。
强大的攻击力:T细胞具有强大的攻击力,能够直接杀死肿瘤细胞。
局限性:
细胞因子释放综合征(CRS):CAR-T细胞治疗可能引起CRS,这是一种可能危及生命的系统性炎症反应。
神经毒性:一些CAR-T细胞治疗与神经毒性相关,可能导致认知和神经系统的副作用。
移植物抗宿主病(GvHD):使用异体T细胞时,存在GvHD的风险,即移植的T细胞攻击宿主组织。
制造过程复杂:CAR-T细胞的制造过程复杂、耗时且成本高,通常需要几周时间。
肿瘤抗原逃逸:肿瘤可能通过改变或丢失CAR-T细胞靶向的抗原来逃避免疫攻击。
优势:
低风险GvHD:CAR-NK细胞不涉及T细胞受体(TCR),因此使用异体NK细胞时不会引起GvHD。
“现成的”制造:CAR-NK细胞可以批量生产,提供“现成的”治疗选项,这可能降低成本并加快治疗进程。
减少CRS和神经毒性:与CAR-T细胞相比,CAR-NK细胞治疗引起的CRS和神经毒性风险较低。
多种肿瘤识别机制:NK细胞可以通过多种机制识别和杀死肿瘤细胞,包括抗原依赖和抗原非依赖的方式。
局限性:
寿命短:NK细胞在体内的寿命较短,可能需要多次输注以维持治疗效果。
实体瘤浸润能力有限:NK细胞可能难以有效地渗透和浸润实体瘤,这限制了它们对肿瘤的攻击能力。
抗肿瘤效果可能有限:由于NK细胞的杀伤机制与T细胞不同,它们对某些类型的肿瘤可能不如CAR-T细胞有效。
病毒转导效率低:NK细胞对病毒转导的抵抗力较强,这可能影响CAR-NK细胞的制造效率。
抗原特异性问题:与CAR-T细胞一样,CAR-NK细胞也面临肿瘤抗原逃逸的问题。
小结
FDA最近对获批的CAR-T细胞产品发出了警告,因为在一小部分接受CAR-T治疗的患者中观察到了T细胞恶性肿瘤。尽管这类事件的总体发生率较低,但在6种获批的CAR-T细胞疗法中有5种产品反复报告了这种情况,导致FDA对这些疗法增加了一类全面的警告标签。
在这些病例中,有三例已经被证明癌细胞含有CAR,表明输入治疗的恶性转化是关键原因。然而,这种恶性转化似乎是一个罕见事件,鉴于目前CAR疗法临床指示的广泛扩展,包括早期治疗阶段的癌症和其他疾病,包括自身免疫疾病和HIV,对罕见不良事件的评估将变得更加重要。
生物技术发展与临床试验数据之间的动态而积极的交流是推动CAR-T和CAR-NK疗法向下一代癌症治疗演进的关键,最终将带来患者治疗效果的改善。
参考文献:Peng L, Sferruzza G, Yang L, Zhou L, Chen S. CAR-T and CAR-NK as cellular cancer immunotherapy for solid tumors. Cell Mol Immunol. 2024;21(10):1089-1108. doi:10.1038/s41423-024-01207-0.
【关于逐典】
上海逐典生物科技有限公司,坐落于中国(上海)自由贸易试验区,获得ISO9001质量体系认证,是一家从事重组蛋白研发和销售的高新科技企业。
逐典生物始终秉持以客户为中心的理念,针对重组蛋白的结构设计、纯化工艺及其稳定剂型相关的多项关键技术进行优化。专业定向蛋白变复性技术,可将大肠杆菌大量表达的变性固体蛋白转变成高活性可溶性蛋白。凭借技术优势,逐典生物新品研发周期短且可控性强,为重组蛋白的高质高效研发提供保障,为企业生产降本增效。
公司自成立以来成功开发百余种高活性细胞因子及多种高活性蛋白酶,覆盖细胞培养、病毒纯化以及质量分析等生物工艺各个环节。可广泛应用于科研、医药生产及IVD(体外诊断试剂)等领域,满足各类用户所需。
