产品中心
技术交流

扫描二维码
CAR-T细胞又一科研进展!新晋诺贝尔奖得主精准锁定肿瘤细胞
文章来源:谈思生物
在对抗肿瘤的过程中,如果治疗手段在消灭肿瘤细胞的同时对正常细胞造成严重损害,显然不是理想的策略。无论是传统的化疗还是新兴的免疫疗法,它们在攻击肿瘤细胞时都可能波及到体内的健康细胞,导致“误伤”和不良反应。
如何精确区分肿瘤细胞与健康细胞,对于CAR-T细胞疗法的研究者而言,是一个至关重要的挑战。CAR-T细胞是经过基因工程改造的免疫细胞,其表面的嵌合抗原受体(CAR)能够识别肿瘤细胞特有的抗原,从而实现对肿瘤细胞的精准攻击。然而,非肿瘤组织有时也会表达相同的抗原,这可能导致患者出现非肿瘤组织的靶向毒性。
最近,《自然》杂志上发表了加州大学旧金山分校(UCSF)的Kole Roibal博士与2024年诺贝尔化学奖得主David Baker教授合作的一项研究成果,他们开发了一种可定制的受体——合成膜内蛋白水解受体(简称SNIPR),这种受体能够确保CAR-T细胞仅在特定环境下,如肿瘤微环境中被激活,从而精确识别并攻击癌细胞,减少对非肿瘤组织的毒性。
研究者认为,这项技术有望带来更精确、更安全的抗癌治疗方法,并且这种方法还有潜力被用来开发针对其他类型疾病的新型靶向治疗策略。

早在2016年,论文的共同通讯作者Kole Roibal博士及其团队就开发出了一种名为synNotch受体的传感器。这种受体能够被嵌入细胞中,进而控制细胞的行为和功能,例如引导T细胞执行特定任务:识别同时表达肿瘤抗原A和B的细胞,并仅在这种情况下激活T细胞的杀伤机制。本质上,synNotch受体是基于天然Notch受体的一种工程化改造版本,它的一部分位于细胞外,用于识别特定的目标,如肿瘤特异性抗原;而另一部分位于细胞内,一旦受体被激活,其胞内部分就会进入细胞核,进而激活或抑制特定基因的表达——比如控制CAR表达的基因。这种方法在很大程度上减少了非特异性的靶向效应。
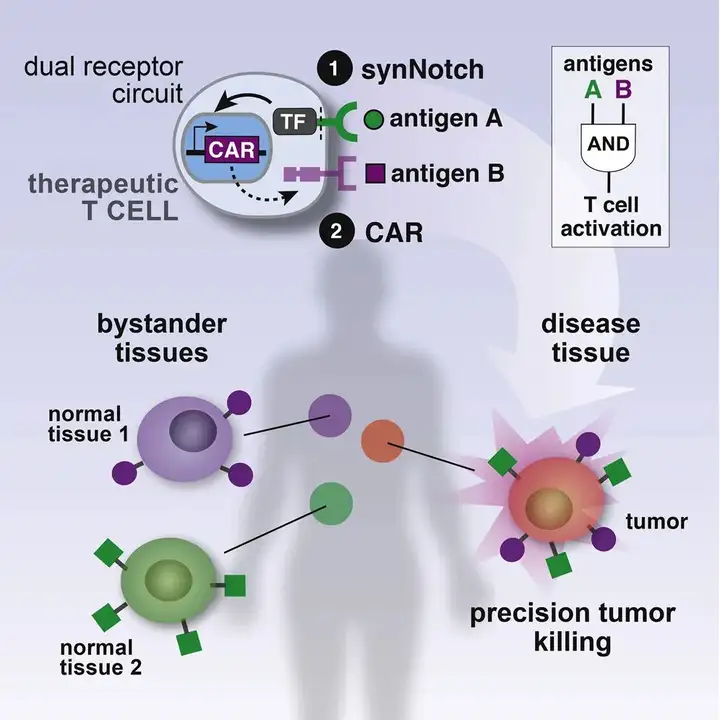
▲synNotch示意图
这项新研究中的SNIPR是synNotch受体的“进阶版”,它经过了进一步的工程改造。SNIPR的胞外部分不仅能够被细胞表面的标记激活,还新增了被可溶性配体激活的能力,这意味着它能够检测细胞周围环境中的任何感兴趣的自由漂浮分子,例如肿瘤环境中的免疫信号分子。当SNIPR与特定的分子结合后,多个受体会聚集并触发内吞作用,翻转至细胞内部,并在pH依赖性条件下发生切割。一个细胞内插入的多个SNIPR可以影响多个不同的基因,或者以不同的方式影响同一个基因,从而调节基因的活性。
基于这一原理,定制化的SNIPR能够确保细胞在特定环境中执行特定的任务,比如释放药物、激活免疫反应或向其他细胞传递信号分子等。

在《自然》杂志发表的这篇论文中,研究团队将新设计的SNIPR受体整合到了CAR-T细胞中,并设定了SNIPR受体由可溶性免疫分子TGF-β和VEGF激活的条件。这两种免疫分子在肿瘤周围的浓度通常较高。因此,装备了SNIPR的CAR-T细胞只有在检测到TGF-β和VEGF时才会激活其抗肿瘤的活性,这意味着它们不会在没有癌细胞的身体区域引发免疫反应。
研究者在含有人类肿瘤的小鼠模型中进行了初步的验证工作,结果观察到装备了SNIPR的CAR-T细胞能够精确地攻击肿瘤,在肿瘤体积减少的同时,并未引起体重下降、器官损伤等常见的CAR-T治疗相关不良反应。
研究团队接下来计划进行CAR-T细胞的临床试验,并探索SNIPR在不同细胞类型中的应用,以促进不同细胞类型之间的通信和与环境的互动,这可能会带来更广泛的治疗应用。
免责声明:本文内容来源于官方网站,旨在为大家提供知识共享,不构成任何专业建议。本资料中所涉及的图片及文字内容仅供参考,若侵犯肖像权或者著作者权等知识产权,请联系我方删除。
【关于逐典】
上海逐典生物科技有限公司,坐落于中国(上海)自由贸易试验区,获得ISO9001质量体系认证,是一家从事重组蛋白研发和销售的高新科技企业。
逐典生物始终秉持以客户为中心的理念,针对重组蛋白的结构设计、纯化工艺及其稳定剂型相关的多项关键技术进行优化。专业定向蛋白变复性技术,可将大肠杆菌大量表达的变性固体蛋白转变成高活性可溶性蛋白。凭借技术优势,逐典生物新品研发周期短且可控性强,为重组蛋白的高质高效研发提供保障,为企业生产降本增效。
公司自成立以来成功开发百余种高活性细胞因子及多种高活性蛋白酶,覆盖细胞培养、病毒纯化以及质量分析等生物工艺各个环节。可广泛应用于科研、医药生产及IVD(体外诊断试剂)等领域,满足各类用户所需。
