产品中心
技术交流

扫描二维码
从上市双抗产品看双抗结构的演变
原创 :球酱,文章来源: bioSeedin柏思荟
1960年,纽约罗斯威尔公园纪念研究所的Nisonoff及其合作者在Science发表的论文中,首次提出了双特异性抗体的概念。
后来随着基因工程、杂交瘤技术、生物大分子重组等技术的飞速发展,双抗的设计和生产逐渐迎来了革新,截至目前,全球已有16款双抗获批上市,在研双抗更是数以百计。
受益于双抗药物逐渐扩大的适应症范围、良好的临床优效性及安全性,双抗药物市场规模持续扩张。2024年上半年,全球双抗药物市场销售额超60亿美元,全年市场规模将稳稳突破百亿美元。
随着跑在前面的双抗产品逐渐迎来收获期,全球各大巨头也开始蠢蠢欲动,重点加码双抗,其中,国内双抗资产也深度参与了这波“双抗热”。
今年7月以来,短短四个多月的时间已经有7款TCE出海交易,其中MNC授权合作俩2起,NewCo出海合作5起,其中康诺亚即完成2起NewCo出海合作交易。
从底层逻辑来看,双抗能在今年再度爆发,实际上是其商业模式得到了验证,这在强调盈利、强调现金流的当下至关重要。而究其原因则是双抗药物不仅在肿瘤方面有极大的治疗潜力,同时在自身免疫疾病、眼科疾病、血友病等赛道,其治疗潜力也不断被挖掘。
加之技术的不断进步和产业的规模化,双抗药物的生产成本预期将逐渐降低,这使得更多患者能够负担起这类高效治疗药物,这大大提高了药物的可及性。
因此,bioSeedin也按照现有双抗产品的上市顺序,详细介绍其获批适应症、历年销售以及抗体结构设计变化。
另外值得注意的是,由药明生物、Cytiva思拓凡联合bioSeedin举办的”第三届蛋白质科学及抗体发现研讨会将于2024年11月21日(星期四),在上海张江海科雅乐轩酒店隆重举行。
本次研讨会将深入探讨当下大分子药物早研领域的热门难点议题,如双特异性抗体、多特异性抗体、抗体偶联药物(ADC)、T细胞衔接器类药物 (TCE)、抗体工程化改造和成药性、药效评估,以及抗体发现的创新策略等,以期为参会者提供最具价值的信息和洞见,为双抗设计提出更多思考。
1.Trion Pharma-Catumaxomab(CD3×EpCAM)
作为全球第一个上市的双特异性抗体,Catumaxomab可同时靶向T细胞表面抗原受体CD3和癌细胞标志物EpCAM。于2009年4月20日获得欧洲药物管理局批准上市,用于治疗恶性腹水。
Catumaxomab上市后的销售额变化情况如下:
2009年获批上市,当年销售额仅为166 万美元;
2010年销售额为 332万美元;
2011年销售额为 443万美元;
2012年销售额为 454万美元;
2014年被停止销售,最终在2017 年 6月正式退市。
做为第一例被FDA批准的双抗,catumaxomab想要达到的应用目标是“一个三功能”的双特异性抗体。如下图所示,左臂靶向EpCAM阳性的肿瘤细胞,右臂recruit T 细胞,Fc端结合NK, Macrophage等效应细胞,通过T cell mediated lysis, cytotoxicity by released cytokines (e.g., IL1β, IL-2, IL-6, IL-12 or DC-CK1), phagocytosis or ADCC等多重效应来杀伤肿瘤细胞。
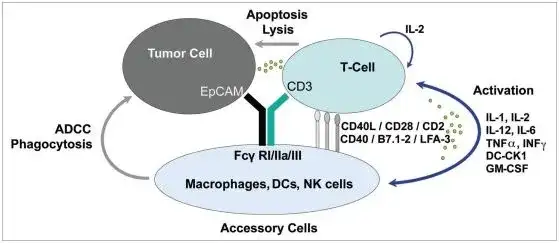
但Catumaxomab设计存在一些缺陷,首先其为鼠源性抗体,免疫原性强;另外易引起T细胞过度活化,诱发细胞因子风暴,引起患者出现发热,恶心,呕吐等副作用。
2.安进-Blinatumomab(CD3×CD19)
2014年12月,安进的Blinatumomab(商品名:Blincyto)经FDA首次批准上市,用于治疗费城染色体阴性的复发或难治性B细胞前体急性淋巴细胞白血病(成人和儿童患者);随后在2017年7 月,FDA将其加速批准转变为完全批准,并扩大了适应症,包括费城染色体阳性的复发或难治性B 细胞前体急性淋巴细胞白血病(成人和儿童患者)
2015年11月获得欧洲药品管理局(EMA)批准,用于治疗成人和儿童的复发或难治性B 细胞前体急性淋巴细胞白血病
在中国,分别于2020年12 月:获批用于治疗成人复发或难治性前体B 细胞急性淋巴细胞白血病;2022年4 月,获批用于治疗成人及儿童复发或难治性前体B 细胞急性淋巴细胞白血病。
上市后销售情况如下图所示
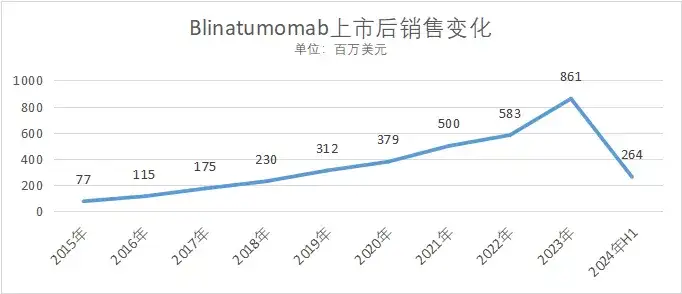
数据来源:安进财报
基于Catumaxomab的设计缺陷案例,Amgen在后续研究时设计了双特异性T细胞衔接器(Bispecific T cell Engager, BiTE)药物技术平台,也是是第一个在全球范围内被批准的BiTE药物,通过采用无Fc区域非IgG样的scFv,降低细胞因子风险。
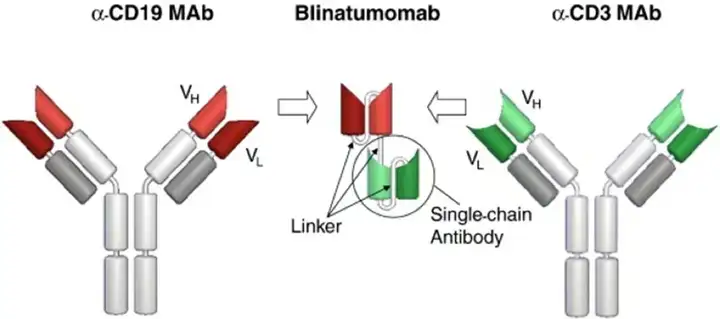
Blinatumomab设计的独特的地方是其对CD3和CD19的亲和力达到了最佳平衡。对靶抗原CD19的亲和力较高,Kd约为10^-9M,这是典型抗体的Kd值;而对CD3的亲和力较低,Kd约为2.6×10^-7M,略高于典型TCR与MHC结合的亲和力。
凭借对靶细胞和T细胞的“平衡”亲和力,Blinatumomab给药后会优先分布到靶细胞表面,随后其抗CD3结构再轻松的和T细胞交联并激活TCR复合物。
此外,合理的CD3亲和力,避免了T细胞和肿瘤细胞长时间的相互作用,从而释放完成工作的T细胞去杀掉下一个目标,这种独特设计将T细胞变成能杀死多个靶细胞的“连环杀手”。
3.罗氏-Emicizumab(IXa(Fib)×FX)
2017年11月16日,FDA首次批准Emicizumab(商品名Hemlibra)用于预防或减少成人和儿童(包括新生儿)患有血友病A(先天性因子VIII缺乏症)的患者出血发作的频率;2018年10月4日,FDA进一步批准用于不存在凝血因子VIII 抑制物的A 型血友病患者,进一步扩大了其适用范围。
2018年2 月23 日,在欧盟获批用于存在凝血因子VIII 抑制物的A型血友病成人和儿童患者的预防性治疗,预防或减少出血发作的频率。
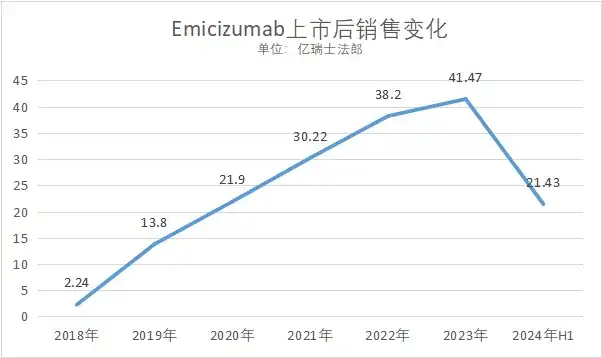
数据来源:罗氏财报
作为一款人源化IgG4亚型双抗。Emicizumab被设计成可以靶向桥连凝血因子IXa和凝血因子X,通过模拟替代凝血因子VIII,促进凝血酶的产生,降低血友病患者的出血率。
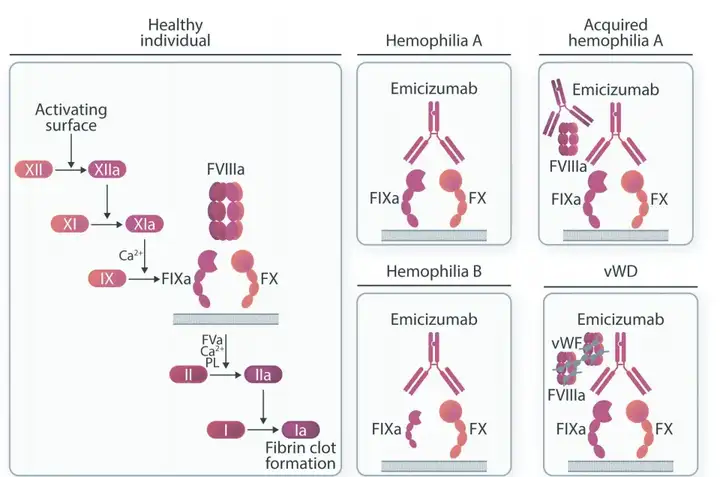
Emicizumab的研发在抗体工程学上也是经典案例,几乎运用了所有工程学方法:Fc engineering to enable the formation of the best hetero-dimer, common light chain screening and optimization, affinity maturation, Fv humanization and optimization, remove deamidation, remove positive patch, remove hydrophobic patch and remove predicted immune-epitope……
4.强生杨森制药-Amivantamab(EGFR×CMET)
Amivantamab(商品名Rybrevant)上市时间及获批适应症如下图所示
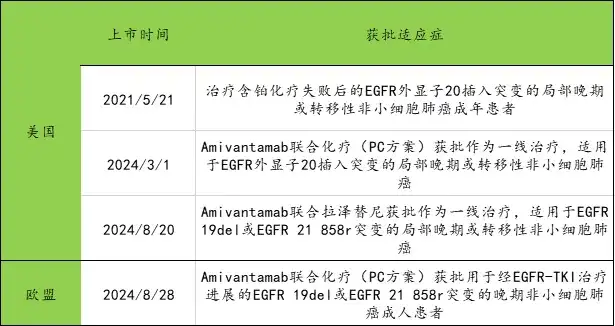
数据来源:公开媒体披露
虽Amivantamab在当时是全球首款获批用于治疗实体瘤的双抗,但目前没有找到官方公布的该年度的准确销售额数据。
据一些市场分析和相关报道推测,其销售额处于初步积累阶段,由于适应症较小,整体数额不会特别高。
但强生却对其非常有信心,2023年12月,强生在投资者日上表示:埃万妥单抗在肺部疾病组合的销售峰值为50亿美元,在一线的市占率剑指50%。如今在其头对头击败奥希替尼,以其强生在全球的商业化渠道布局,达到这个数字已经不是困难的事情。
从设计架构上来看,Amivantamab源自2种亲本单克隆抗体(mAb),其中1种靶向EGFR,1种靶向MET。使用Genmab DuoBody 控制的抗原结合片段(Fab)臂交换过程组合亲本mAb,产生对每种抗原具有单臂结合位点(即单价)的双特异性抗体。

此外,亲本mAb是在工程化细胞系中产生的,该细胞系将低水平的岩藻糖掺入Fc区,以增强抗体与免疫效应细胞上的FcR的结合,从而促进抗肿瘤免疫细胞定向活性。
5.罗氏-Faricimab(VEGF×ANG2)
Faricimab(商品名Vabysmo)上市时间及获批适应症如下图所示

上市首年,Faricimab便实现了6.19亿美元销售额;2023年,Faricimab的销售额高达26.34亿美元,增幅达到了惊人的324%;2024前三季度,Faricimab贡献销售收入32.45亿美元。
Faricimab凭借比单抗阿柏西普头对头更优效的数据,以及更长间隔的给药周期,自2022年上市以来加速放量。未来或将拿下更多市场份额,销售额有望冲击50亿美元的大关。
Faricimab作为靶向VEGF-A和Ang-2的双特异抗体,其结构为1+1的非对称形式,为了方便生产,抗体采用罗氏经典的CrossMab设计防止轻链的错配,并采用Knob-in-Hole防止重链错配。同时对抗体的Fc进行改造,去除抗体对FcγR的结合能力,从而减少抗体ADCC,ADCP和CDC等效应对眼部相关细胞的损伤。
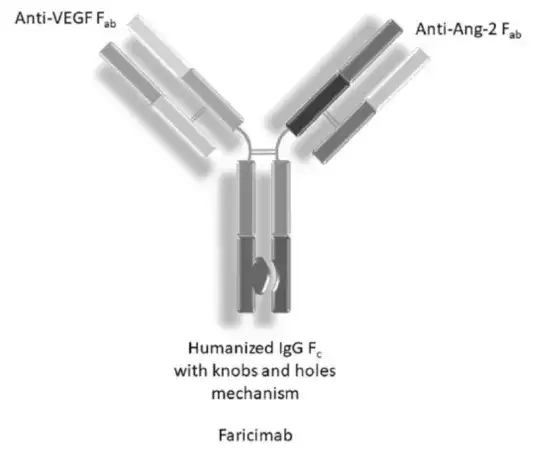
除此之外,为了降低抗体系统性的暴露,抗体同时去除了Fc与FcRn的结合,从而降低抗体的半衰期,进而防止大量的抗体通过再循环进入血液提升抗体的安全性。
6.Immunocore-Tebentafusp(Gp100×CD3)
Tebentafusp(商品名Kimmtrak)作为首个上市的TCR药物,开创了一个全新的药物研发领域。
从适应症获获批情况来看,2022年1 月25日,FDA批准Tebentafusp用于治疗HLA-A*02:01阳性的不可切除或转移性葡萄膜黑色素瘤成人患者。
从销售情况来看,2022年上市首年销售额达1.4亿美元,2023年增长至2.4亿美元;2024上半年,Tebentafusp净销售额为1.46亿美元。总体来说,虽Tebentafusp在3期临床数据中打败了K药和CTLA-4单抗,在降低患者死亡风险和延长OS上都有明显优势,但因为价格(40万美元/年)和患者群体受限的原因,Tebentafusp可以说销售平平。
从抗体结构来说,ebentafusp是一种新型双特异性TCR-scFv融合蛋白,创新性地将靶向肿瘤抗原的TCR与结合CD3的免疫效应结构域结合在一起,TCR部分靶向gp100,scFv部分则靶向CD3以募集T细胞。
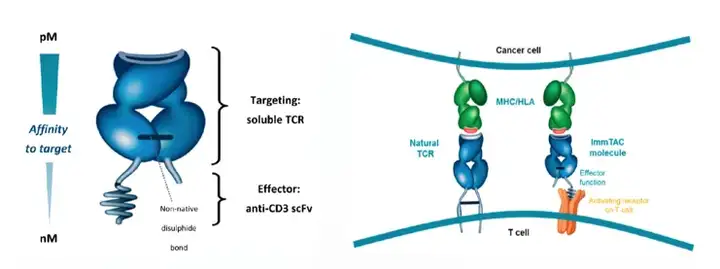
Tebentafusp的结构(左)和作用机制(右)示意图
除此之外,Tebentafusp是使用Immunocore的ImmTAC技术平台开发的第一个分子,旨在重定向和激活T细胞以识别和杀死肿瘤细胞。相比于单抗等其他肿瘤免疫疗法靶向细胞表面蛋白,ImmTAC分子有望能够靶向细胞内和细胞外靶点,激活针对癌细胞强有效且具特异性的T细胞应答。
7.康方生物-Cadonilimab(PD-1/CTLA-4)
Cadonilimab(商品名:开坦尼)作为一种全球首创的PD-1/CTLA-4双特异性抗体肿瘤免疫治疗新药,它由中国康方生物自主研发,于2022年6月29日获得NMPA的批准上市,主要用于治疗既往接受含铂化疗治疗失败的复发或转移性宫颈癌(R/MCC)患者。
2024年9月30日,NMPA正式批准卡度尼利单抗联合XELOX一线治疗不可手术切除的局部晚期复发或转移性胃或胃食管结合部腺癌。
从康方生物发布的年度财报数据来看,Cadonilimab 2022年上市6个月的销售额为5.46亿元;2023年销售收入13.58亿元;2024 H1,在只获批宫颈癌二线及以上疗法的情况下,Cadonilimab实现约7.057 亿元的销售额,同比增长16.5%。
随着一线胃癌、一线宫颈癌新适应症的不断获批,Cadonilimab仍有强劲的增长势头。
Cadonilimab是基于康方生物Tetrabody双抗技术构建的四价双抗,也是第一种同时靶向PD-1和CTLA-4的双特异性抗体,采用IgG1-ScFv对称结构。IgG1骨架相较于IgG4等亚型具有更稳定的结构特征,可以显著降低抗体药物的宿主细胞残留,减少过敏反应或输液反应。
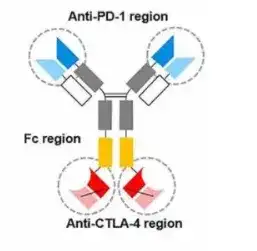
Cadonilimab抗体结构
在Fc端引入氨基酸点突变,效应沉默设计有效减少抗肿瘤免疫细胞的消耗。Fc段的优化,一方面完全去除ADCC、CDC、ADCP等效应,避免Fc介导免疫细胞活化引起免疫不良反应,另一方面减少抗体依赖性细胞因子释放(ADCR)效应,减少IL-8释放以增强疗效,也减少了IL-6释放以降低免疫相关不良反应。临床前研究表明,其四价设计增强其在肿瘤微环境中的高结合活性。
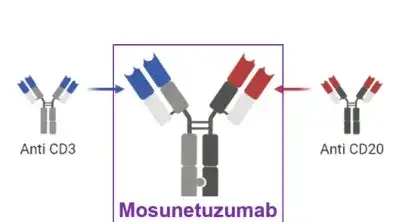
8.罗氏-Mosunetuzumab(CD20×CD3)
Mosunetuzumab(商品名Lunsumio)作为罗氏公司开发的一款CD20×CD3双抗,于2022年6月在欧盟获得附条件上市批准,用于治疗至少接受过2次系统治疗的R/R FL成年患者,成为了全球首个获批上市CD20/CD3双抗;2022年12月22日,FDA批准mosunetuzumab的上市申请,用于治疗二线或以上全身治疗后复发或难治性(R/R)滤泡性淋巴瘤(FL)患者。
2024前三季度Mosunetuzumab销售收入6084万美元。根据预测,到2027年CD20/CD3双抗的销售额将会占据双抗市场25%,而Mosunetuzumab可能仅有1亿美元的销售额,这主要是其治疗领域为FL,治疗领域较小。
从抗体设计上来看,Mosunetuzumab结构类似于天然抗体,但含有2个Fab区,其中一个Fab区靶向恶性B细胞表面的CD20,另一个Fab区靶向效应T细胞表面的CD3。使效应T细胞向恶性B细胞靠近。
9.Ablynx-Ozoralizumab(TNF×albumin)
Ablynx公司研发的Ozoralizumab(商品名:Nanozora)是全球首款获批上市的双特异性纳米抗体,2022年9月于日本获批上市,用于治疗类风湿性关节炎(RA),尤其适用于对现有治疗反应不充分的RA患者。
2014年9月,Ablynx将Ozoralizumab在大中华区的开发和商业化授权给亿腾医药(Eddingpharm);2015年6月,Ablynx将Ozoralizumab在日本的开发和商业化授权给大正制药(Taisho)。
从结构上来看,Ozoralizumab是一款人源化、三价的双特异性纳米抗体,其中2个靶向人TNF-α(结合TNF-α的两个亚型),1个与人HSA结合延长药物半衰期。
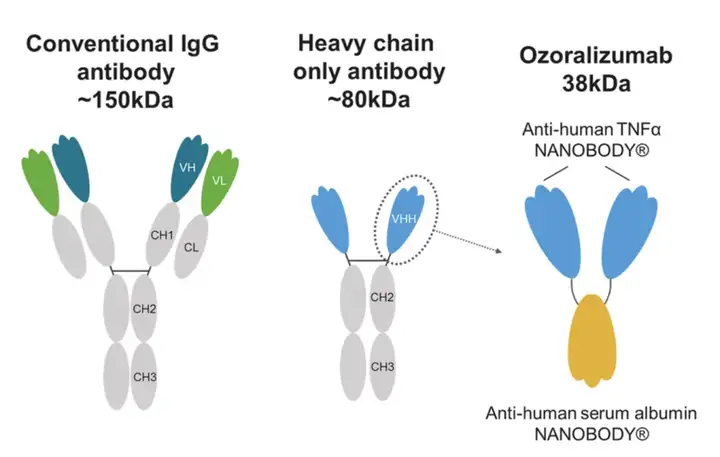
值得一提的是,作为双抗的Ozoralizumab真正起到治疗作用的靶点实际上只有TNF-α,而靶向HSA的纳米抗体通过结合HSA来延长药物半衰期,属于辅助结构域。这一做法也有效的弥补了纳米抗体由于个头小导致的半衰期短的问题,如此一来单次给药后平均半衰期能延长到18.2天。
Ozoralizumab不会引起大结构免疫复合物的形成,降低了免疫原性,并且Ozoralizumab不会被Adalimumab诱导的ADA中和。
10.强生-Teclistamab(BCMA×CD3)
Teclistamab(商品名Tecvayli)于2022年8 月25日,欧盟委员会已批准其作为单一疗法用于治疗复发和难治性多发性骨髓瘤(RRMM) 成人患者的有条件上市许可,此次获批标志着teclistamab 在世界范围内首次获批上市。
2022年获美国FDA批准上市,用于治疗经过至少四线治疗的复发或难治性多发性骨髓瘤成人患者。
2024 年6 月25日,获NMPA批准单药治疗用于既往接受过至少三种治疗的复发性或难治性多发性骨髓瘤(r/rmm)成人患者。
从商业化成绩来看,Teclistamab 2024 Q1收入1.33亿美元、Q2收入1.35亿美元、Q3收入1.35亿美元,环比增长基本停滞,爬坡不理想。
Teclistamab是一种采用Genmab DuoBody®技术研制的针对BCMA和CD3的IgG4双抗,BCMA结合结构域和CD3结合结构域分别在抗体的不同臂上,分子量146KD。
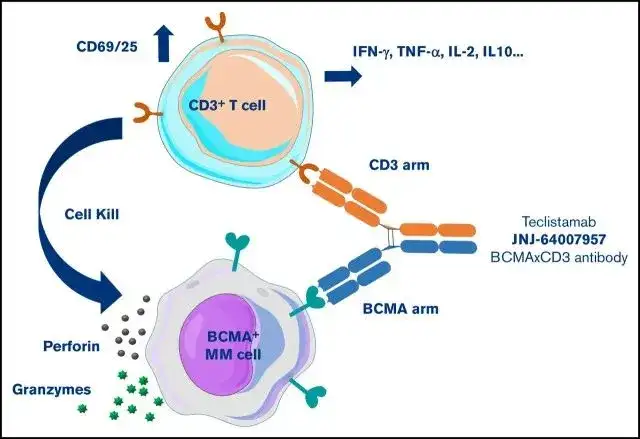
作用机制上靠着将细胞毒性T细胞拉到肿瘤细胞附近,让细胞毒性T细胞分泌穿孔素和各种颗粒酶来杀伤肿瘤细胞。
11.艾伯维/Genmab-Epcoritamab(CD3×CD20)
在美国市场,Epcoritamab(商品名Epkinly)2023年5 月首次获美国FDA 加速批准,用于治疗先前接受过2 线以上的系统性疗法的复发或难治性(R/R)弥漫性大B 细胞淋巴瘤成人患者。2024年6 月,获FDA批准用于治疗复发或难治性(R/R)滤泡性淋巴瘤成人患者,这些患者先前接受过2 线以上的系统性疗法。
欧盟市场,2023年9 月获得欧盟EMA 批准,用于治疗复发或难治性(R/R)弥漫性大B 细胞淋巴瘤成人患者。
同月,Epcoritamab在日本获批上市,治疗滤泡性淋巴瘤、高级别B 细胞淋巴瘤、纵隔大B 细胞淋巴瘤、大B 细胞淋巴瘤(三线)、弥漫性大B 细胞淋巴瘤。
从销售情况来看,Epcoritamab自2023年上市之后,半年时间卖出3100万美元,今年上半年翻倍至6300万美元。作为FDA批准的首款治疗DLBCL的双抗产品,Epkinly的前景被市场寄予厚望
在抗体设计上,Epcoritamab的构建是基于Genmab的Duobody双特异抗体平台,抗体为1+1型非对称IgG1双特异抗体。为了消除的Fc相关效应功能,抗体的Fc端进行了L234F,L235E,D265A突变。
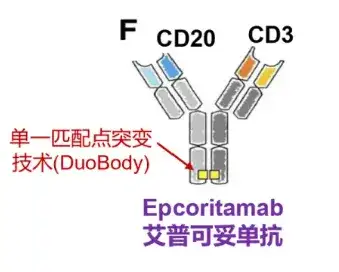
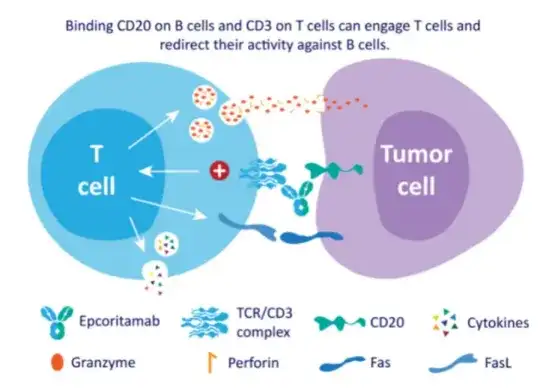
Epcoritamab与CD20 B细胞以及CD3 T细胞同时结合,激活和扩增T细胞,并介导CD20阳性恶性B细胞的T细胞介导杀伤。当CD3 T细胞与CD20恶性B细胞双特异性结合时,形成免疫突触,导致恶性B细胞的穿孔素/颗粒酶B诱导的凋亡。
12.罗氏-Glofitamab(CD3×CD20)
2023年6月16日,glofitamab(商品名:Columvi)获FDA加速批准上市,用于治疗既往接受过至少两线系统性治疗的复发或难治性弥漫大B细胞淋巴瘤(DLBCL)或由滤泡性淋巴瘤引起的大B细胞淋巴瘤(LBCL)成人患者。
2024前三季度,glofitamab共贡献了1.16亿瑞士法郎的销售收入。
Glofitamab是一种IgG1类结构、Fc段沉默(silence)、具有独特2:1结构的CD20/CD3双特异性抗体,同时与B细胞CD20和T细胞CD3结合,诱导T细胞的激活和针对恶性肿瘤B细胞的免疫反应,从而实现抗肿瘤效应。
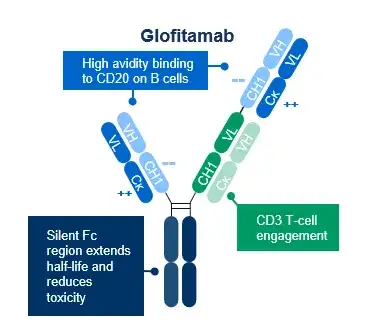
临床前研究显示,相较于1:1结构,Glofitamab在体外肿瘤杀伤的平均水平增加了40倍。这使得Glofitamab即使在先前或同时服用靶向CD20的单抗药物的情况下依然有效,有利于仍需服用CD20单抗药物的复发患者,或者利用CD20单抗预处理来降低细胞因子风暴不良反应的给药策略。
13.辉瑞-Elranatamab(BCMA×CD3)
2023 年8 月14日,FDA加速批准Elranatamab(商品名:Elrexfio)用于治疗复发/ 难治性多发性骨髓瘤成人患者,这些患者之前接受过至少4 种疗法,包括蛋白酶体抑制剂、免疫调节剂和抗CD38 单克隆抗体。
2023 年10月,欧洲药品管理局人用药品委员会建议批准Elranatamab用于治疗复发性或难治性多发性骨髓瘤患者。
目前辉瑞暂未对Elranatamab的销售额进行披露。不过GlobalData预测Elranatamab到2029年销售额5.36亿美元,辉瑞预计峰值40亿美元。
从抗体结构上来看,Elranatamab是一种人源化的双特异性抗体,它同时靶向多发性骨髓瘤细胞上的BCMA和T细胞上的CD3。通过激活和引导T细胞,elranatamab能够诱导T细胞对多发性骨髓瘤细胞产生细胞毒性反应。
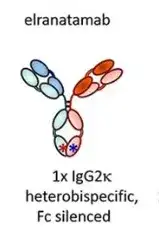
该抗体的每个Fc半部的CH3结构域都有突变,这些突变促进异二聚化而不是同二聚化,从而推动两个Fc半部形成异源特异性。轻链特异性问题则通过两对互补的突变(CD3结合部分的CH1 和CL 各一对)来解决。
14.强生-Talquetamab(GPRC5D×CD3)
2023年8月10日,强生宣布美国FDA加速批准该公司talquetamab(商品名:Talvey)上市,用于治疗复发或难治性多发性骨髓瘤成人患者,这些患者先前至少接受过4种治疗,包括蛋白酶体抑制剂,免疫调节剂和CD38抗体。
作为继BCMA指导的Tecvayli之后,第二个用于多发性骨髓瘤的双特异性抗体。Talquetamab是一款first-in-class现货型双特异性T细胞结合抗体,能同时靶向MM细胞上的GPRC5D和T细胞上的CD3。
强生2023、2024年报、季度报暂未披露Talvey销售情况,但据FIERCE预测,2023年新获批的罕见病药物中有5款药物将超过10亿美元,具有成为重磅产品的潜力,其中强生Talquetamab销售峰值约为50亿美元。
从结构上来看,talquetamab是一种IgG4κ/λ,S/P铰链稳定二价双特异性TCE抗体,使用Dubody控制的Fab交换过程产生的。它的其中一个Fab臂与T细胞表面表达的CD3ε受体结合,另一个Fab臂与MM细胞和非恶性浆细胞以及健康组织(如皮肤和舌角化组织的上皮细胞)表面表达的GPRC5D结合。
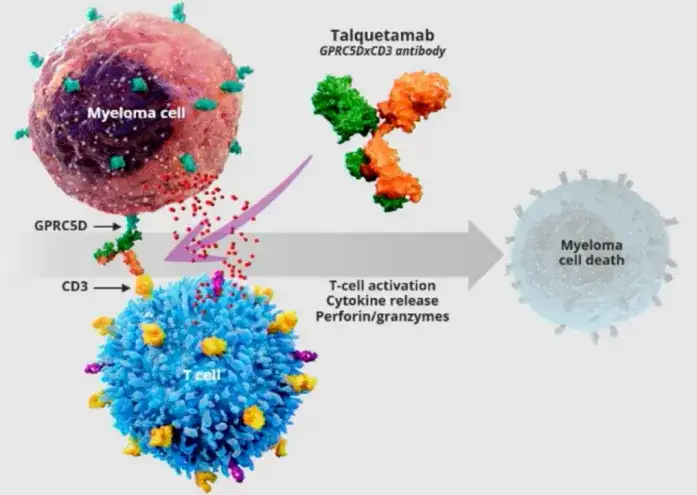
临床前研究结果已证实,Talquetamab通过招募和激活CD3阳性T细胞,诱导T细胞介导的GPRC5D阳性多发性骨髓瘤细胞的杀伤,并抑制肿瘤的形成和生长。
15.安进-Tarlatamab(DLL3×CD3)
Tarlatamab(商品名Imdelltra)于2024 年5 月16 日获美国FDA加速批准。其获批的适应症为用于治疗在铂类化疗期间或之后疾病进展的广泛期小细胞肺癌(ES-SCLC)成人患者。
该药物是目前首个也是唯一一款获批用于治疗侵袭性肺癌的DLL3 靶向双特异性T 细胞接合剂疗法。
Tarlatamab在获批上市首个季度(2024年Q2)销售额是0.12亿美元,2024年Q3销售额增长到0.36亿美元,预计上市首年即达成销售破亿美元milestone应该不成问题。
从分子结构上来看,Tarlatamab是一种偶联了IgG Fc片段的双特异性 T 细胞接合剂 (BiTE) 抗体,外侧scFv靶向 小细胞肺癌 (SCLC) 肿瘤中选择性表达的delta 样配体 3 (DLL3),内侧scFv靶点T细胞表面表达的CD3蛋白。
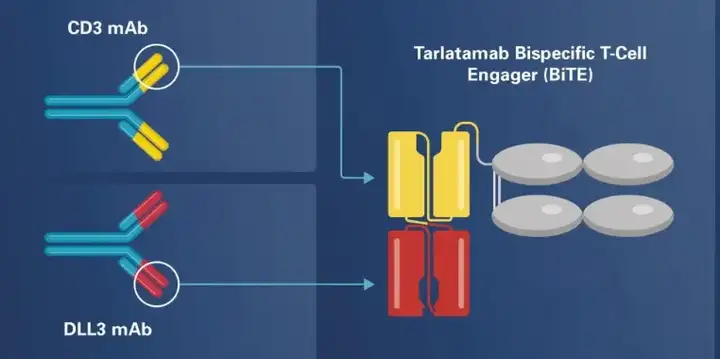
Tarlatamab作为一种靶向SCLC 细胞上的Notch 配体DLL3 和T 细胞上的CD3 复合物的BiTE),与DLL3 阳性SCLC 细胞体外孵育时会激活T 细胞,导致SCLC 裂解。Tarlatamab在SCLC的播散性原位模型中也表现出显著的体内肿瘤消退效果。
16.康方生物-Ivonescimab(PD-1×VEGF)
5 月24 日,NMPA官网显示,康方生物的Ivonescimab(商品名:依达方)国内获批上市,联合培美曲塞和卡铂用于经EGFR 酪氨酸激酶抑制剂(EGFR-TKI)治疗后进展的EGFR 突变的局部晚期或转移性非鳞NSCLC 的治疗。
根据康方生物2024 年中期业绩公告,截止6 月30 日,Ivonescimab实现销售收入1.03 亿元。
作为全球首个获批上市的“肿瘤免疫+抗血管生成”机制的双特异性抗体新药,依沃西单抗注射液可同时靶向PD-1和VEGF两个靶点,同时与VEGF-A、PD-1结合,竞争性阻断VEGF-A、PD-1与其配体的相互作用。“同时阻断这两个靶点,可以更有效地阻断这两个通路,从而增强抗肿瘤活性。
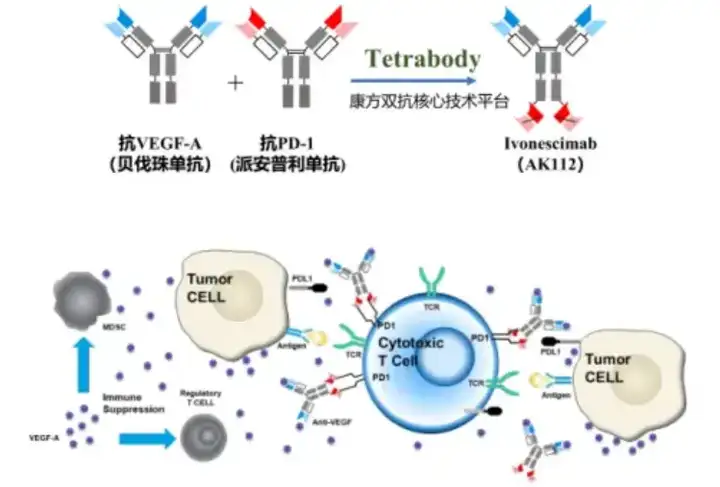
相比于PD-1单抗和抗VEGF抗体的双药联合,AK112实现了“一药双靶”,增强了抗肿瘤活性,在临床上展现了广阔的应用前景,这种药物的上市为患者提供了全新的治疗选择。
【关于逐典】
上海逐典生物科技有限公司,坐落于中国(上海)自由贸易试验区,获得ISO9001质量体系认证,是一家从事重组蛋白研发和销售的高新科技企业。
逐典生物始终秉持以客户为中心的理念,针对重组蛋白的结构设计、纯化工艺及其稳定剂型相关的多项关键技术进行优化。专业定向蛋白变复性技术,可将大肠杆菌大量表达的变性固体蛋白转变成高活性可溶性蛋白。凭借技术优势,逐典生物新品研发周期短且可控性强,为重组蛋白的高质高效研发提供保障,为企业生产降本增效。
公司自成立以来成功开发百余种高活性细胞因子及多种高活性蛋白酶,覆盖细胞培养、病毒纯化以及质量分析等生物工艺各个环节。可广泛应用于科研、医药生产及IVD(体外诊断试剂)等领域,满足各类用户所需。
