产品中心
技术交流

扫描二维码
最新进展:提升哺乳动物细胞瞬时基因表达效率的关键策略
作者:Biotech 文章来源:Biotech share
在生物制药行业日益竞争激烈的背景下,快速、高效地生产重组蛋白已成为决定企业成败的关键。哺乳动物细胞瞬时基因表达系统(TGE)以其周期短、操作简便等优势,成为重组蛋白生产的核心技术之一。然而,提升TGE的表达效率和稳定性仍是当前研究的重点。
本文深入分析了TGE系统的最新改进策略,包括细胞系优化、表达载体设计、培养基改进和共表达辅助基因的应用,为生物制药研发提供了切实可行的优化方案,展示了该技术在推动生物制药产业化中的巨大潜力。

前言
重组治疗蛋白(包括抗体)的生产是生物制药领域的核心组成部分,其表达系统涵盖了细菌、酵母、哺乳动物细胞系和植物等多种形式。其中,常用的哺乳动物细胞系统包括中国仓鼠卵巢细胞(CHO)、小鼠骨髓瘤细胞(NS0和Sp2/0)以及人胚胎肾293细胞(HEK293)。在2014至2018年期间,CHO细胞仍然是最常用的哺乳动物细胞培养系统。数据显示,在通过哺乳动物细胞生产的107种产品中,有95种(即89%)是使用CHO细胞生产的,其次是HEK293细胞。CHO细胞不仅能够生产具有复杂结构的蛋白质,还具有大规模培养的能力,并且对病毒感染具有较强的抵御能力。HEK293细胞则以其在无血清悬浮培养中易于生长和快速繁殖的特点著称,且在使用常见的转染试剂时表现出高效的转染能力,因此在药物发现和毒性测试中被广泛应用。
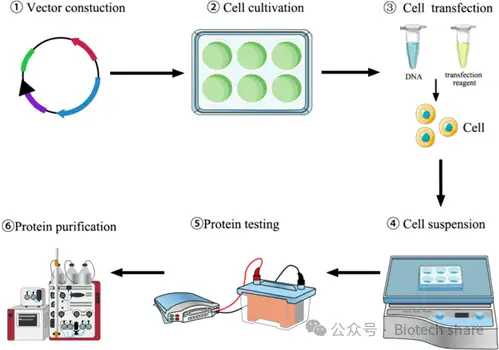
哺乳动物细胞表达系统主要分为两种方式:瞬时转染表达(TGE)和稳定转染表达(SGE)。TGE相比SGE具有更快的启动过程,不需要繁琐的筛选步骤,目的基因(GOI)可以直接转入宿主细胞(图1),快速实现蛋白表达。然而,TGE系统的产量通常低于SGE,这也是限制大规模TGE应用的主要瓶颈。为了提高TGE的产量和效率,主要改进策略集中在优化各个环节,包括表达载体的设计、转染方法的选择、转染条件的调整、培养工艺的优化、培养基的改进以及细胞系的改良。本文将对TGE系统及其在哺乳动物细胞表达中的最新改进策略进行详细综述和分析。
宿主细胞系
通过瞬时基因表达(TGE)在这些哺乳动物细胞中快速生产重组蛋白是生物制药开发早期阶段中的重要工具。TGE系统主要由表达载体、细胞系和培养基组成,每个组成部分在高效蛋白质生产中都扮演着至关重要的角色。
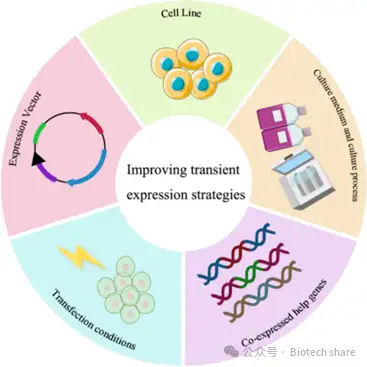
◉CHO细胞:蛋白表达量的高低主要取决于基因的转录和翻译水平,宿主细胞可以通过不同途径调控基因的转录和翻译过程,来影响蛋白的表达量。在TGE系统中,最常用的宿主细胞系是HEK293细胞和CHO细胞。CHO细胞来源于中国仓鼠的雌性卵巢组织,由于其在重组蛋白生产中的广泛应用,研究人员已分离出多个CHO细胞的亚型,并对其进行了不同方向的开发。这些亚型包括CHO-S、CHO-K1、CHO-DXB11、CHO-DG44、CHO-M以及GS敲除的CHO细胞。每种亚型都具备不同的基因型和表型特性,适应不同的生产需求。目前,重组蛋白生产中广泛应用的CHO细胞系主要有CHO-K1、CHO-DXB11和CHO-DG44三种。在选择合适的CHO宿主细胞进行蛋白质生产时,关键是根据特定需求选择具有最佳特性的表达系统或细胞系。以下是常见CHO细胞表达系统和细胞系的特点总结(表1)。
表1 瞬时表达用CHO细胞表达系统和细胞系的特征细胞系
| 细胞系特征 | 优势 | |
|---|---|---|
| CHO-K1细胞 | 最早分离的CHO细胞,适应性强,生长快速 | 适合基因转染实验和重组蛋白的表达 |
| CHO-S细胞 | 用于悬浮培养,增殖速度快 | 对培养基成分有良好的适应性,适用于工业化生产。 |
| CHO-DG44细胞 | 缺乏二氢叶酸还原酶(DHFR) | 便于建立稳定细胞株,适合长时间重组蛋白生产。 |
| CHO-EBNA细胞 | 可维持重组基因的长期表达 | 高效且适合持续生产,表现出良好的蛋白表达能力。 |
| CHO-S(EBNA)细胞 | 结合了CHO-S细胞和EBNA的优点 | 适合快速实验需求,表现出良好的蛋白表达和分泌能力。 |
◉HEK293细胞:HEK293细胞系及其亚型(293E、293T、293F)也是一种广泛应用于瞬时基因的表达系统,具有基因操作简便、高转染效率、无血清悬浮培养下实现高密度生长等优势。然而,其在N-聚糖结构差异、临床应用受限及易受病毒污染等方面存在局限性。通过优化糖基化修饰、加强病毒污染控制和合理选择亚型,可以提升其蛋白质生产效率与质量。
◉表达载体:表达载体是瞬时基因表达(TGE)系统的重要组成部分,负责携带目标基因进入宿主细胞,并调控其表达,包括启动子、增强子、终止子和选择标记等调控元件。不同的调控元件组合会影响基因表达效率和重组蛋白的产量(表2)。
表2 TGE系统中的关键调控元件总结调控
| 元件 | 作用 | 常见示例 | 影响 |
|---|---|---|---|
| 启动子 | 决定基因转录的起始效率,调控基因表达的强度 | CMV、EF1α、SV40、SCP | 超级核心启动子能够增强基因转录活性,提高目的蛋白表达及其稳定性 |
| 增强子 | 协助启动子增强转录效率,提升基因表达的量 | SV40 enhancerCMV enhancer | 增强基因表达,增加转录效率 |
| 终止子 | 终止转录并确保mRNA稳定性,影响mRNA的寿命与转运 | BGH Poly(A)SV40 Poly(A) | 提高mRNA稳定性,间接增强蛋白表达 |
| 选择标记 | 筛选成功转染的细胞,确保目标蛋白的有效表达 | Neo、Puro、GFP | 确保筛选阳性细胞群,提高表达的纯度 |
| 复制元件 | 提供质粒复制功能,增强外源基因的表达持续性 | oriP(与EBNA-1蛋白结合)、SV40 ori(与大T抗原结合) | 延长质粒在细胞中的维持时间,提升蛋白产量 |
◉细胞培养基:细胞培养基为细胞的生长和蛋白表达提供必要的营养,是确保高效表达重组蛋白的关键因素。安全、有效的培养基不仅能够提高蛋白产量,还能简化下游的纯化过程。传统的细胞培养常需在基础培养基中加入10-20%的血清,以维持细胞生长。然而,血清在不同批次中的差异、其易受支原体污染,以及其复杂的蛋白质成分,都会增加后续蛋白分离和纯化的难度。
◉SFM:为克服这些局限,无血清培养基(SFM)成为理想替代方案。SFM由明确的血清替代成分和基础培养基组成,减少了血清对细胞培养的影响。这不仅能够使下游的分离和纯化过程更为简便,同时降低了生产成本,提高了工艺的一致性和安全性。因此,SFM在工业化蛋白生产中具有显著优势,有助于简化流程并提升重组蛋白的质量。瞬时基因表达改
细胞系改造
细胞系的改造主要通过提高转染效率、引入抗凋亡基因、过表达内质网伴侣蛋白以优化蛋白折叠和分泌、调整糖基化修饰、以及调节细胞代谢途径来提升蛋白质生产的效率、产量和质量。这些改造方法广泛应用于CHO和HEK293等细胞系中,Macaraeg等在CHO-K1细胞中敲除了两个诱导细胞凋亡的基因Bax和Bak,构建了双敲除(DKO)细胞,DKO细胞所表达的抗体产量比对照组高出3至4倍。Major等构建的Bcl-xL细胞系在14天的批次培养后,融合蛋白的产量增加了70%至270%,细胞活力维持在90%以上,且凋亡率降低。Zhong等的研究显示,ExpiCHO-S™ TGE系统能够产生高水平的重组抗体,与其他系统相比具有显著的表达产量提升,同时具有所需的转录后修饰(PTMs)。Chen等的研究中,人类17β-羟基类固醇脱氢酶1在HEK293T细胞中通过TGE得到了高水平表达,经过72小时的转染后达到了17mg/L的最高表达水平。Jäger等进一步优化了HEK293细胞中的单链可变区抗体(scFv Fc)的TGE系统,达到了10-20mg/L的抗体表达产量。为了进一步提升产量,研究者使用了带有EBNA-1截短变体的HEK293-6E悬浮细胞。这种改进极大提高了抗体的体积产量,使产量增加了10倍,达到140mg/L。
表达载体工程
瞬时基因表达载体工程是设计和构建质粒载体以促进目标基因在宿主细胞中短时间内高效表达的过程。通过优化表达载体的组成元件,可以提高瞬时基因表达(TGE)的效率和产量。
➣启动子:启动子是可以被RNA聚合酶特异性识别并结合的DNA调控序列,从而有效启动转录。人类巨细胞病毒(hCMV)的即早期启动子是哺乳动物细胞中驱动重组蛋白表达的常用的启动子。Jostock等研究指出,在HEK293T细胞中,由CMV启动子驱动的IRES介导的双顺反子载体能够实现平均IgG瞬时表达量超过10μg/mL。进一步的研究表明,采用相同CMV启动子的双启动子载体系统的抗体滴度达到最高,分别比双顺反子和双载体系统提高了1.4倍和1.9倍。此外,Yang等构建了双顺反子、单顺反子和双启动子载体,并在CHO细胞中进行了瞬时表达,发现双启动子载体在CHO细胞中的表达量最高,达约18 ± 4μg/mL。这些研究结果表明,双启动子策略在提高重组抗体产量上更具优势,主要机制可能在于重链(HC)和轻链(LC)基因通过不同启动子转录,实现了更高的转录独立性和表达灵活性,从而增强了抗体的瞬时表达效率。
Poulain等研究指出,在累麦基因开关启动子(CR5)的驱动下,重组蛋白的体积产量显著提升,比CMV启动子或杂合EF-1α-HTLV组成启动子的表达量高出三到四倍,此结果表明CR5启动子在蛋白质表达中具有显著优势。Brown等的研究则表明,通过抑制YY1转录抑制因子的活性,分泌型碱性磷酸酶(SEAP)的产量可增加1.5倍,这一发现表明,通过调控CMV启动子来优化CHO细胞的瞬时表达(TGE)可以增加重组蛋白的生产效率。另外,Gupta等通过转染密码子优化的酵母细胞质丙酮酸羧化酶(PYC2)和使用强效融合启动子,显著提升了PYC2酶的表达水平,使单mAb的产量提高了5%,同时显著提升了糖基化的产物质量,甘露糖化水平提高了两倍,半乳糖化水平提高了2.5倍。这些研究结果表明,通过启动子选择、转录因子的调控和基因优化,可以实现重组蛋白表达和质量的显著改善。
➣顺式元件:顺式元件是通过调控基因转录效率和稳定性,在载体工程中起到重要作用的遗传元件。常见的顺式元件包括基因座控制区(LCR)、核基质附着区(MAR)和普遍染色质开启元件(UCOE)。其中,UCOE是CpG岛中未甲基化的基因启动子,通过防止转染过程中DNA甲基化引起的沉默效应,有助于维持高水平的转基因表达。Nematpour等的研究表明,UCOE能够提高细胞系的抗体产量,特别是与重链结合使用时,其稳定性更好,能够进一步提升单克隆抗体的产量。
MAR则是另一种重要的顺式元件,它作为表观遗传调控因子,通过与核基质特异性结合,参与基因表达的调控过程。相比没有MAR的对照载体,含有MAR的质粒在转染CHO细胞时,能够显著提高重组蛋白的表达水平。LCR则是调控转基因表达的核心元件之一,研究表明,LCR通过慢病毒载体能有效增强抗体的滴度和基因转移效率。此外,Mariati等研究了五种转录后调控元素(PTREs),包括热休克蛋白70(Hsp70)、163bp长剪接变体(SP163)、与主要晚期启动子增强子(TM)连接的人腺病毒mRNA的三部分首码序列、内含子A以及野鼠肝炎病毒转录后调控元素(WPRE)。结果显示,TM能够提供最高的基因表达水平,使表达水平提高了3.6到7.6倍。
其他PTREs元素也能显著提高蛋白表达水平,幅度为1.7到3.2倍。而多种PTREs的组合则进一步使重组蛋白的表达增加至10.5倍,特别是WPRE与内含子A、SP163或TM的组合具有叠加效应。
➣信号肽的优化:信号肽的优化是提高重组蛋白分泌效率的重要策略。Kober等人通过对16种不同信号肽的效果进行比较,发现来自人血清白蛋白和嗜中性粒细胞特异性蛋白(azurocidin)的信号肽效果最佳。进一步的补料批次分析验证了这些结果,在稳定转染的细胞池中,使用这些信号肽可以实现高达90pg/cell/day的细胞特异性产量,且使用白蛋白信号肽的抗体产量达到4g/L。然而,最合适的信号肽选择可能因蛋白质种类而异。
Haryadi等人研究了两个κ轻链信号肽(L1和L2)和八个重链信号肽(H1–H8)在五种不同抗体生产中的表现。结果表明,不同抗体的最佳信号肽组合并不一致。例如,Avastin、Herceptin、Rituxan、Remicade和Humira的最佳信号肽组合分别为H7/L1、H5/L1、H7/L2、H7/L2和H7/L1。这些研究表明,信号肽的优化需要根据每种抗体的特性进行具体分析。O’Neill等人则使用计算机模拟技术设计合成信号肽,并评估其对三种不同重组蛋白的表达效果。这三种蛋白包括一个单链变体融合蛋白、一个易于表达的单克隆抗体(ETE),以及一个难以表达的单克隆抗体(DTE)。研究显示,最优信号肽方案具有高度的蛋白质特异性,能够分别将ETE轻链、DTE轻链和单链变体融合蛋白的产量提高1.8倍、2.5倍和2.7倍。这表明,信号肽的选择与目标蛋白质的特性密切相关,优化信号肽能够显著提高重组蛋白的分泌效率。
培养基和培养条件优化
培养基添加物
培养基和培养条件的优化是提高哺乳动物细胞中重组蛋白表达的重要手段。蛋白胨作为一种富含肽、氨基酸和无机盐的水溶性蛋白水解物,能够显著改善细胞培养效果。Davami等通过将蛋白胨添加到无血清培养基中,显著提升了HEK293-EBNA细胞瞬时转染表达(TGE)的产量,并使CHO细胞的体积生产力提高了37%。类似地,Burteau等的研究发现,补充小麦蛋白胨使细胞生长增加了30%,同时干扰素-γ(IFN-γ)的生产提高了60%,这表明植物来源的蛋白胨不仅能够提高哺乳动物细胞的生长,还能增强产品产量。Ye等研究通过在批次培养中补充二甲基亚砜(DMSO)和乙酸锂(LiAc)对CHO细胞瞬时转染的影响,结果表明这些添加物显著提高了IgG的生产,最终产量达到80mg/L。类似的研究中,Lynch等发现,在转染后4小时向HEK293细胞培养基中添加10%的DMSO,能够将重组蛋白的表达水平提高约1.6倍,同时未观察到显著的细胞毒性。此外,伴侣蛋白在重组蛋白生产过程中扮演着重要角色,能够辅助蛋白质正确折叠并防止蛋白聚集。DMSO在蛋白折叠途径中表现出伴侣蛋白样的功能,减少了蛋白质聚集现象,进而提高了生产效率。
降温策略
在工业生产中,降温策略被广泛用于提高哺乳动物细胞中重组蛋白的产量。通常,哺乳动物细胞在培养初期保持在37℃的标准温度下,以促进细胞快速生长和增殖。随着培养进入生长抑制阶段,温度通常会降低至31℃或33℃,以优化蛋白质生产。Lin等发现,通过将培养温度降至33℃,虽然降低了HEK293S细胞的生长速率,但绿色荧光蛋白(GFP)和α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(AMPA)受体的表达显著增加了约1.5倍。降温通过使细胞在G1/G0期停滞并抑制细胞凋亡,从而提高了重组蛋白的产量,并增强了细胞活力。同时,降温还能提高与内质网蛋白折叠和加工相关的基因(如ddit3、atfx、bp1s5、grp78、trib3、grp94和ero1α)的表达,这些基因调控未折叠蛋白反应和内质网驻留蛋白的产生,从而改善蛋白质加工和分泌。
Sou等研究表明,将培养温度降至32℃进行瞬时转染表达(TGE)相比于在36.5℃条件下培养,能使产量的qP提高76%。这一增幅伴随着氨基酸和营养物质的消耗增加,同时核苷糖种类的产量也有所增加,重组单克隆抗体的半乳糖化速率显著提高。Zhang等提出,在哺乳动物细胞的大规模生产过程中,可以在悬浮培养的第3天将温度降至33℃,以提高治疗蛋白的产量。
此外,Barron等的研究表明,降温可调节miRNA的表达,六种miRNA(mir-219、mir-518d、mir-126、mir-30e、mir-489和mir-345)在降温下显著上调,而四种miRNA(mir-7、mir-320、mir-101和mir-199)则下调。这些miRNA的表达变化与重组蛋白生产的增强密切相关。Fischer等发现,miR-30e的过表达能够使CHO细胞中分泌型碱性磷酸酶(SEAP)的产量提高约两倍。而在CEVEC的羊膜细胞生产系统中,miR-136、miR-3074和miR-219的过表达显著提高了单克隆抗体的最终浓度。Sanchez等的研究进一步表明,抑制miR-7几乎使CHO细胞中SEAP的产量翻倍。这些结果表明,降温策略不仅通过调控细胞周期和蛋白折叠途径增强蛋白表达,还通过miRNA的调节机制显著提高了重组蛋白的生产效率。
转染条件优化
合适的聚合物
转染的每个步骤对最终结果都有不同程度的影响,因此优化转染条件至关重要。通过选择适合的转染试剂、调整DNA和试剂的用量、控制细胞密度,可以提高转染效率和重组蛋白的产量。优化后的转染方案应具备操作简便、成本低、流程短、效率高的特点,以满足高效生产的需求,并在保持产量的同时确保产品质量。
Daramola等使用阳离子脂质基试剂对CHO-S细胞进行瞬时转染,在1L摇瓶批量培养中获得了60mg/L的重组IgG。Kadlecova等研究了一种新型转染试剂-超支化聚赖氨酸(HBPL),发现其转染效果与传统的PEI或Fugene1相当,甚至在某些情况下更高。HBPL具有不需要复杂预孵育、适用于含血清培养基且可生物降解的优势,从而降低了细胞毒性并简化了下游处理流程。Delafosse等则发现,使用去酰化的PEI “Max”和PEIpro™相比于常规PEI,能够显著提高重组蛋白的表达水平。这些研究表明,选择最合适的聚合物对优化瞬时基因表达(TGE)系统非常重要。
添加比例
de Los Milagros Bassani Molinas等开发了一种完全无血清的瞬时转染方法,采用不含钙的DMEM和FreeStyle™ 293表达培养基的1:1混合物,通过优化DNA和PEI的比例(1:3),在转染后72小时内达到最大转染效率(70-96%),并获得1.6 μg/mL的重组人促红细胞生成素。Johari等设计了一种脂质体介导的双相SP35Fc特异性TGE过程,利用免疫抑制因子CYPB共表达来最大化产量,并通过最佳比例(5:1)消除SP35Fc的聚集,从而将产量提高了六倍,同时避免了二硫键聚集体的形成。此外,苯环醇(DNA聚合酶抑制剂)与丁酸盐(组蛋白去乙酰化酶抑制剂)的联合预处理,通过电穿孔显著增加了荧光强度。在CHO细胞中荧光强度增加了4.8倍,在HEK293细胞中增加了2.8倍,而在HEK293-EBNA细胞中则增加了1.9倍。这些优化方法表明,通过调整不同的转染条件,可以大幅提高瞬时基因表达的效率和蛋白质产量。
通过优化DNA(N)与PEI(P)的比率,可以显著提高转染效率和重组蛋白的表达。研究发现,当DNA/PEI(w/w)比率为1:3时,转染效率最高,范围在60%到66.93%之间。此外,Rajendra等研究表明,使用非特异性填充DNA来替代部分编码DNA时,尽管编码DNA量减少67%,重组蛋白的生产仍与对照组相当。填充DNA不会影响编码DNA的细胞摄取或稳定性,反而增加了转染细胞的比例和转基因mRNA的稳定性。
瞬时转染的优化还需要考虑多种因素,包括培养基类型、悬浮细胞密度、质粒DNA和PEI的用量。Haldankar等人通过优化这些转染参数,获得了高达9.4mg/L的重组蛋白表达水平。Liu等使用阳离子脂质转染试剂FreeStyle™ MAX对HEK293和CHO细胞进行转染,通过优化参数,获得了约70%的eGFP阳性细胞和50–80mg/L的IgG抗体分泌。转染系统扩大到1L时,保持了相似的转染效率和蛋白产量,并提高了人红细胞生成素和凝血因子IX的表达。
此外,在HEK293T细胞系中,对质粒DNA进行72°C加热处理30分钟显著提高了转染效率。González-Domínguez等通过实验设计(DoE)优化了转染参数,发现在NaCl浓度为125mM和孵育时间为11分钟的条件下,获得了最高的转染产量。这些研究表明,通过优化转染条件,可以显著提升重组蛋白的表达效率和产量。
共表达调节蛋白
X-box结合蛋白
调节蛋白的共表达对细胞生长和重组蛋白的表达起到了显著的促进作用。Rajendra等人的研究表明,过表达X-box结合蛋白(XBP-1S)能够使CHO细胞中几种治疗蛋白的产量增加15%至85%。此外,Cain等发现,过表达XBP-1S和内质网氧化还原酶(ERO1-La)的CHO-S细胞系相比对照组,其抗体产量增加了5.3至6.2倍。
miRNA
某些miRNA的共表达也可以提高重组蛋白的产量。Jadhav等人通过miRNA筛选发现,miR-17能够促进CHO细胞的生长并提高蛋白生产力。Ohsfeldt等人的研究显示,过表达Bcl-xL基因的CHO细胞在转染表皮生长因子受体或成纤维生长因子受体3后,重组蛋白的表达量显著增加,证明Bcl-xL的共表达可以提高蛋白产量。Zustiak等也发现,Bcl-xL共转染的CHO细胞凋亡率降低,特异生产力提高,重组蛋白产量增加了约100%。
其它调节因子
此外,Budge等人发现,核苷酸二磷酸激酶A(NDPK-A)的共表达提高了CHO细胞的转染效率,并且当NDPK-A与EBNA-1结合时,重组蛋白的瞬时表达显著增加。Lee等人通过建立共表达EBNA-1和多瘤病毒大T抗原(PyLT)的CHO细胞,显著提高了Fc-融合蛋白的表达量,qP比对照细胞高出22.9倍。Daramola等的研究也表明,EBNA-1与GS的共表达增强了CHO细胞中重组抗体的瞬时基因表达。
Roobol等人发现,瞬时过表达真核起始因子3(eIF3i)复合物可提高CHO-K1细胞中整体蛋白的合成速率约10%。此外,Vink等人描述了一种基于快速生长悬浮细胞系FreeStyle™ 293-F的优化系统,通过与表达增强质粒的共转染,在不到一周内获得了高达400 mg/L的分泌抗体产量。这些研究表明,通过调节蛋白的共表达,能够显著改善重组蛋白的生产效率。
小结
哺乳动物细胞的瞬时基因表达(TGE)系统以其周期短、操作简单的优势,成为重组蛋白生产的重要平台,尤其适用于初步研究和快速筛选。TGE系统的核心组成包括细胞系、表达载体和培养基。通过细胞系的改造、载体工程的优化、转染条件的筛选,以及培养基配方和工艺流程的改进,TGE系统生成的重组蛋白的表达水平和质量得到了显著提升。此外,共表达辅助基因,如XBP-1S、Bcl-xL等,进一步增强了蛋白的合成和分泌效率。
然而,尽管TGE系统具备多项优势,重组蛋白的表达仍然受到批次间差异、转染效率波动等因素的影响,导致表达水平有待进一步提升。随着组学技术(如基因组学、转录组学、蛋白质组学等)的发展,以及数据分析技术和人工智能的融合,更加精准、高效的TGE系统将为工业化重组蛋白的生产提供更可靠的解决方案。这些新兴技术将推动TGE系统在大规模生产中更广泛的应用,从而满足生物制药和研究领域对高效蛋白生产的需求。
参考文献:
[1]Fu Y , Han Z , Cheng W ,et al.Improvement strategies for transient gene expression in mammalian cells[J].Applied Microbiology & Biotechnology, 2024, 108(1).DOI:10.1007/s00253-024-13315-y.
逐典生物定制化原核蛋白表达服务
上海逐典生物的科学家团队在定制原核蛋白领域潜心钻研十余年,积累了极为丰富的分子设计、蛋白筛选以及工艺开发经验。迄今,已成功交付了数百种细胞因子和定制酶。逐典生物定制化原核蛋白表达服务以先进的技术平台为支撑,其中人工智能驱动的分子设计平台,可对蛋白的结构与功能进行优化设计,从而显著提高蛋白的表达效率与活性;高通量蛋白制备平台能够快速支持蛋白的表达和筛选,充分满足客户需求;此外,还有独特的包涵体变复性平台,有效解决了原核表达蛋白因错误折叠而形成包涵体这一痛点问题。
服务优势
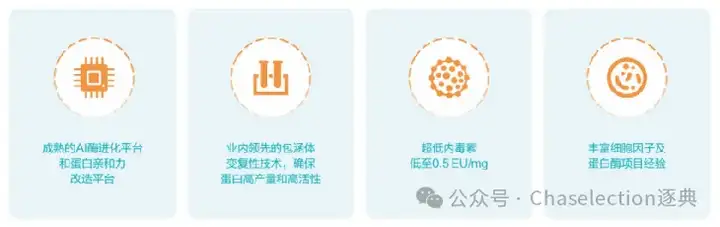
服务流程
服务详情