产品中心
技术交流

扫描二维码
间充质干细胞(MSC)培养系统
本文来自微信公众:生物工艺与技术 作者:开朗的豌豆射手
MSC 培养系统
细胞培养添加物
细胞治疗用途的监管要求是,它们必须在质量体系下或使用良好生产规范 (GMP) 进行生产。在此系统中,所有工艺输入(培养基、添加物、生长因子)也需要在 GMP 条件下生产,包括试剂验证、批次测试和使用前根据适当的放行标准放行。这意味着,在考虑生产工艺的所有部分时,如果生产的细胞要用于临床,生物反应器必须在质量体系下使用。许多细胞培养系统符合这些标准,下目前正在使用(见图2)。这些培养系统的输入包括细胞、培养基、添加物(通常是动物血清)和生长因子。合成培养基(无血清或无异种)通常已包含支持细胞生长的分子,但可能需要在生长表面预先涂上重组蛋白或支持细胞附着的片段。
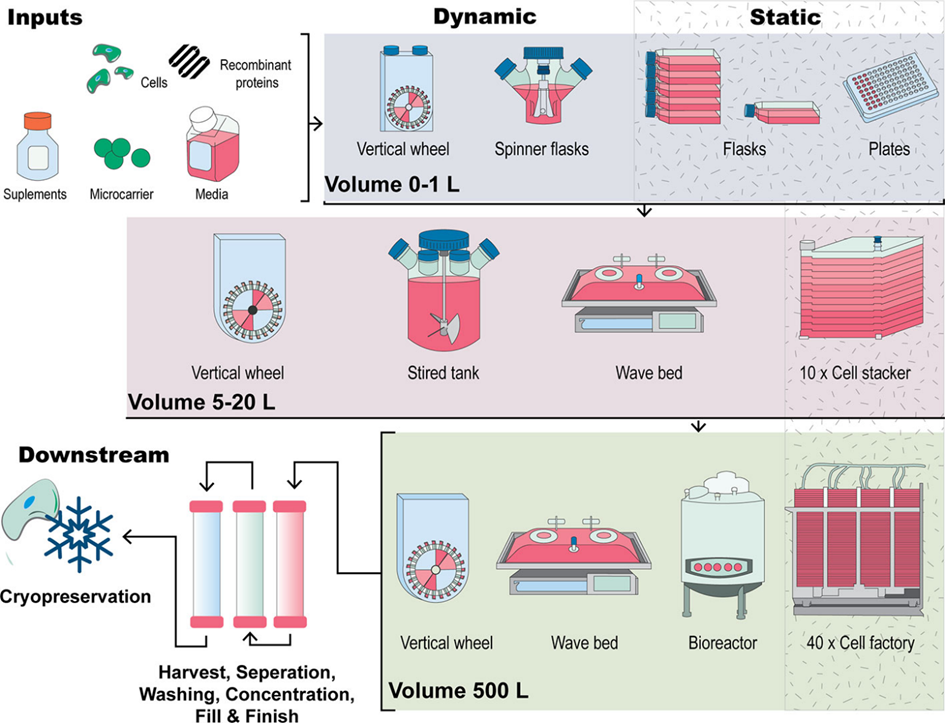
图2. 人类 MSCs 扩增策略的比较。该过程的输入包括细胞、培养基、添加物、培养表面(培养瓶、细胞平面堆叠系统、微载体)和其它添加物,包括生长因子。传统培养方法包括 2D 平面技术,例如通过连续传代在培养皿或培养瓶中扩增 MSCs。这种方法的放大使用细胞堆栈或多层培养瓶,它们通过增加培养瓶以这种方式工作。相比之下,3D生产方法涉及 MSCs 形成聚集体或以悬浮状态接种到生物反应器系统(例如搅拌罐、垂直轮或波袋生物反应器)中的微载体上。下游工艺,例如细胞收获、细胞清洗、细胞浓缩、完成和灌装以及通过冷冻保存储存,也是生产用于临床应用的 MSCs 的关键部分。
MSC 扩增培养基中含有血清(通常为牛血清或人血清),为生长提供营养,为细胞粘附提供附着促进蛋白(例如纤连蛋白和玻璃粘连蛋白),以及为体外刺激细胞增殖提供激素和脂质。然而,胎牛血清 (FBS) 的使用最近引发了人们的担忧,即动物蛋白和肽可能会在培养过程中污染人类 MSCs。这可能导致病毒或朊病毒传播,并在临床环境中引起异常的免疫反应。在某些情况下,在移植细胞暴露于 FBS 的临床环境中检测到了针对 FBS 蛋白的抗体。此外,使用 FBS 还存在伦理问题。进一步的问题涉及批次间差异以及为了细胞生产目的对 FBS 进行广泛鉴定的要求。FBS 的供应有限和成本高也是细胞疗法应用的一个限制。例如,对 FBS 可用性的估计表明,未来供应不太可能满足需求,特别是考虑到 FBS 是肉类工业的副产品。已经研究了补充人血清(同种异体和自体),并且混合人 AB 血清(hABS)的使用正变得越来越普遍,至少在体外研究中是如此。在一项此类研究中,与 FBS 相比,使用 hABS 可显著增强 MSC 在 2D 培养中的扩增,且具有相似的免疫抑制作用。在这项研究中,hABS 还用于从组织中分离 MSC 并进行冷冻保存。Savelli等人在中空纤维灌流生物反应器中培养 MSC,发现与在添加有 FBS 的培养基中培养相比,特定细胞群(中胚层祖细胞 (MPC))得到了富集,而 FBS 仅观察到 MSC 表型。在合理规模的平面和微载体培养中 MSC 扩增的比较研究中,测试了补充人 AB 血清的情况。发现基于微载体的系统可显著提高每平方厘米的细胞数,比平面系统更高效,但高效收获被认为是获得最大细胞产量的障碍。当然,也存在一些限制,例如可以提供的数量以及传播以前未知或新的人类病原体的风险。
大规模 MSC 生产的常见替代方案是按照质量体系或良好生产规范 (GMP) 指南制备人类血小板裂解物 (HPL)。HPL 具有强大的生长促进活性,可支持多种细胞的扩增。事实上,目前有大量研究表明,使用 HPL 时来自各种组织来源的 MSCs 增殖率更高,并且一般而言,利用 HPL 进行MSCs体外扩增的研究发现,在保持细胞特性以供临床应用方面,它是 FBS 的可接受替代品。然而,关于 HPL 对 MSCs 免疫抑制能力影响的研究一直存在矛盾。在一项研究中,与 FBS 相比,HPL 扩增的 MSC 表现出表面分子表达改变、淋巴细胞受损和自然杀伤细胞抑制。在另一项研究中,观察到在添加有 HPL 的培养基中扩增的 BM-MSC 具有更高的免疫抑制作用。比较在添加有 HPL 或 FBS 的培养基中的细胞扩增的其它研究报告称,BM-MSC 的免疫抑制作用或 A-MSC 的分泌概况没有差异。在 HPL 中生长的细胞的染色体稳定性似乎相同,甚至更好。尽管 HPL 被认为是一种安全的临床扩增工具,但将其作为 MSC 扩增的 FBS 替代品仍有局限性。鉴于目前的文献尚不清楚 HPL 对 MSC 免疫抑制的共识影响,因此需要进一步研究以阐明 HPL 对 MSC 体内免疫抑制能力的影响。已经有许多临床研究涉及使用 HPL 作为 MSC 生产的添加物来扩增 MSC,结果表明 HPL 可以安全地替代 FBS 用于临床规模的 MSC 生产。此外,最近对生产用于 GvHD 的细胞的欧洲中心进行的一项调查显示,77% 的中心优先使用 HPL 而不是 FBS(在培养基中主要以 5% 的剂量添加)。
市面上有越来越多的合成细胞培养基,它们针对 MSC 进行了优化,以避免生物来源的培养基添加物的批次间差异问题。这些培养基通常不含动物或人类来源的添加物,可描述为无血清或无异种 (SF 或 XF)。例如,Gottipamula 等人比较了在一系列 SF 和 XF 培养基中小体积培养扩增的 BM-MSC 的生长动力学、细胞表面标志物、形态、分化潜力和免疫抑制特性,并且一种培养基也用于 10 层 cellSTACK®。与 FBS 培养基相比,cellSTACK® 中的细胞产量较低,这突显出即使从小规模扩大生产规模也会带来一些挑战。可能需要在每个测试规模上进行优化。这些培养基仍然相当昂贵(每单位体积的价格与 FBS 和 HPL 大致相同),这意味着据我们所知,它们目前尚未用于扩增细胞以供临床应用。随着更广泛使用带来的规模经济,成本预计会降低。表1总结了上述每种培养基添加物类型的相对优缺点,特别是人源和合成培养基添加物与动物源添加物(如 FBS)相比的优势和劣势。
表1. 常用的细胞培养基生长添加物总结;胎牛血清 (FBS)、混合人 AB 血清 (hABS)、人血小板裂解物 (HPL) 和合成培养基及其在细胞治疗环境中的相对优缺点。

MSCs 的 2D 与 3D 培养在治疗应用中的比较
传统上,未分化的 MSCs 在具有平面的培养容器中以二维 (2D) 单层条件以低密度维持和扩增,细胞粘附在培养板或培养瓶的塑料表面。细胞粘附在平坦表面上并在上面生长,形态扁平,并在扩增过程中从一侧接收营养物质和生长因子。由于培养的开放性质以及产生足够供研究使用细胞所需的细胞传代次数,该过程相对劳动密集型且易受污染。通常,2D 培养条件是静态的,并且缺乏通过传感器进行监控和控制培养条件的能力,这对于细胞生产来说是不利的。原代 MSC 单层培养物在大量传代后也会衰老并失去其表型,这可能会影响临床疗效。因此,从生产角度来看,考虑到组织中 MSC 的相对稀有性以及临床使用所需的细胞数量,每年可能需要从多个供体生产多个主细胞库。这种追求更高传代次数和最大扩增、以从单个主细胞库中获得最大患者剂量的驱动力需要与潜在的临床疗效降低相平衡。平面培养系统的其它缺点包括临床规模下细胞生长所需的大表面积,在更换培养基、传代和细胞收获过程中需要操作大量液体,并且需要大型培养箱,而这在洁净室中占用了相当大的空间。
为了在 2D 条件下增加细胞数量,使用多层培养瓶或细胞堆叠容器来增加培养皿的表面积。图 2表示平面 2D 静态培养中的小规模、中规模和大规模细胞生产,从组织培养瓶到 10 层和 40 层堆叠系统。市面上有几种细胞堆叠系统,包括 Corning® CellSTACK 和 Nunc™ Cell Factory™。这种生产方法称为“横向扩展”放大,其中单元大小保持不变,并行单元成倍增加(图 2)。然而,这种技术导致表面积与体积比受限,从而造成生产过程的瓶颈。细胞堆叠系统内的环境也是非均质的:每个培养瓶都构成不同的微环境,容易受到污染、批次间差异和供应商之间不均匀表面处理的影响。此外,手动操作和下游细胞处理挑战限制了技术放大的潜力。治疗性细胞输注所需的高 MSC 剂量 [每公斤患者约 10^6 cells] 需要“规模放大”方法。
规模放大是指生物反应器等技术中整体生产规模的增加。图 2描绘了多种生物反应器类型,包括搅拌罐、波浪式袋和垂直轮。在 1967 年 van Wezel 设计的微载体培养系统中,细胞在微载体表面繁殖,并通过缓慢搅拌在生长培养基悬浮液中扩增。由此,开发了结合微载体的搅拌或混合生物反应器系统,可提供 10^6至 10 ^7 cells/mL的密度,成为比平面堆叠系统更适合制备治疗细胞的方法。此外,与组织培养瓶相比,生成相当数量细胞所需的生物反应器系统培养时间更短,可以最大限度地降低因血清培养而导致 MSC 衰老和表型改变的风险。其它用于增加细胞生长表面积而不增加生物反应器占地面积的方法包括使用中空纤维生物反应器以及固定床灌流系统。许多纵向放大系统的一个重要特征是能够以功能封闭的方式操作它们。这意味着可以“打开”生物反应器进行连接,然后返回到封闭状态。这样,生物反应器的内容物就不会暴露在室内环境中。这带来了明显的优势,因为多个单元可以在同一房间内操作,而无需彼此物理隔离。
搅拌罐和其它动态生物反应器
典型的搅拌罐式生物反应器通常是带有搅拌桨以提供恒定运动的圆柱形容器,并且是用于基于 MSC 的细胞疗法(特别是需要生产大量细胞的同种异体细胞疗法)的最广泛使用的放大生物反应器系统。然而,搅拌罐配置可实现有效混合,但流动不均匀,在生物反应器内的某些条件或区域可能会形成湍流。生物反应器放大技术促进动态悬浮培养,这与静态 2D 培养截然不同。生物反应器内的细胞可以扩增为悬浮细胞聚集体,或接种到称为微载体的小固体球上。对于 MSC,已发现使用此方法进行扩增通常可保持稳定的表型,至少在仅考虑 MSC 的最小定义时是如此。由于自组装细胞聚集体或球状体模拟原位条件,细胞形态更能代表身体组织中的细胞形态。细胞聚集形成球状体的介质需要粘附分子来促进细胞与细胞之间的附着,包括层粘连蛋白、整合素、E-钙粘蛋白和玻璃粘连蛋白。然而,对于 GMP 生产,这些重组人类蛋白质价格昂贵,难以进行大规模生产。
原则上,基于微载体的培养系统特别适合 MSC 扩增。与 2D 系统相比,微载体微球具有较大的表面积,可最大限度地提高 MSC 的附着率。使用微载体的生物反应器还可以在更高的密度下运行,从而降低供应成本或商品成本 (COG)。例如,一项研究调查了在搅拌罐生物反应器系统中使用基于微载体的 2.5 L 培养物扩增 MSC,发现较大体积的培养物优于 100 mL 的小体积“转瓶”培养物,产生的细胞具有符合 MSC 的 ISCT 定义的表型、关键形态和分化能力。微载体由各种材料制成,可以涂有生物活性蛋白质和肽(例如玻璃粘连蛋白和纤连蛋白)。此外,基于微载体的技术可以作为封闭的培养系统运行,并与灭菌程序兼容,这在考虑治疗应用时至关重要。
尽管三维 (3D) 放大生产系统利用微载体和搅拌罐系统,具有诸多优势,但也存在一些潜在问题。需要进一步改进动态培养系统中 MSC 的扩增,以实现不变且可重复的 MSC 生产,以供生物研究和最终临床应用。此外,仍需要开展研究,以更广泛地了解生产方法与临床疗效之间的联系,以及如何优化生产以获得最佳临床结果。这对于 MSC 尤其重要,因为它们适用于多种疾病适应症,可能需要不同的特性,这些特性可以通过优化生产,根据疾病进行定制。
在搅拌罐式生物反应器系统中进行 MSC 放大
常用的生物反应器系统对 MSC 的大规模生产可能存在许多问题。这主要是因为此类系统最初设计用于大规模进行化学反应,后来适应于以生物工艺或从非贴壁细胞(例如 CHO 细胞)生产治疗性蛋白质的形式进行的细胞培养。对于基于细胞的疗法的生产,保持细胞功能和质量是最重要的,然而,在将大规模生产系统应用于 MSC 的大规模生产时,这一方面往往被忽视。
有多种不同的商业生物反应器可用于扩大 MSC 的生产规模 (图 2 )。生物反应器在支持 MSC 生长和表型维持方面的性能不能成为选择生物反应器时考虑的唯一变量。还必须考虑其它标准,例如以功能封闭的方式运行的能力、操作简便性、一次性、无菌、结合在线监测和控制的能力、自动化、易于收获以及时间和成本效益。这必须与实际考虑因素相平衡,例如低成本和实现高细胞密度的能力。
搅拌罐式生物反应器系统操作方便,细胞培养体积可通过计算机控制的在线监控设备扩大,设备可控制 pH 值、温度、溶氧和二氧化碳浓度等过程变量。然而,搅拌生物反应器也引入了一个重要的复杂因素:流体力学。生物反应器中的细胞不断暴露于由搅拌桨的机械搅拌引起的剪切应力。MSCs 对这种应力特别敏感,这可能导致细胞损伤、过早从微载体上脱落、启动至特定分化谱系或影响免疫调节特性。在搅拌生物反应器系统中的微载体上扩增 MSCs 时,必须认识和控制这些影响。归根结底,利用微载体的动态培养系统非常复杂,与 2D 系统相比面临不同的挑战。微载体的聚集尤其重要,因为它们的存在可能会降低细胞收获效率。减少聚集的一种方法是定期添加更多微载体,增加培养表面,并允许细胞从汇合的微载体迁移到稀疏或空的微载体。从可行性的角度来看,已经在 3 和 50 L 的一次性搅拌罐生物反应器中进行了骨髓源性 MSCs 的扩增。与 FBS 相比,在添加 HPL 的培养基中的扩增得到增强,在 50 L 培养体积规模下,11 天内扩增了 43 倍。根据 ISCT 定义维持 MSC 表型以及免疫抑制特性。
由于 MSC 依赖于贴壁,因此必须能够轻松地将其从培养基质中分离,且不改变其免疫表型、分泌组或分化能力,而这些都与临床疗效密切相关。动态系统中的细胞收获通常使用蛋白水解酶(如胰蛋白酶)(单独使用或与螯合剂(如 EDTA)结合使用)将细胞与微载体和细胞-微载体聚集体分离,然后通过适当的网眼过滤以去除微载体和大聚集体。与单层细胞培养策略不同,微载体-MSC 复合物需要特别复杂的分离方法,并且分离效率往往会有所不同。多项研究已经用高浓度或长时间的胰蛋白酶处理细胞-微载体复合物。已知这种处理会导致 MSC 损伤或诱导表型变化。例如,在室温下用 0.25% 胰蛋白酶-EDTA 溶液处理 MSC 5、30 和 90 分钟,CD105 表达随时间降低。其它研究已经调查了替代性蛋白水解酶,例如胶原酶和分散酶,以通过消化大孔微载体来收获 MSC。这种方法限制了细胞损伤并增加了分离数量。然而,也有研究表明,用这些酶处理细胞时,某些细胞表面分子也会下调或裂解。
另外,使用热敏微载体(通过降低培养温度来分离 MSC-微载体复合物)表明,通过温度变化分离细胞可减少 MSC 在收获过程中的凋亡和细胞死亡,这表明热敏微载体在 MSC 培养中是有效的。热敏微载体存在许多潜在问题,包括可能也需要酶消化的细胞聚集体。无论如何,考虑细胞类型和微载体类型并确定最佳酶促方案以最大限度地提高收获细胞的数量和质量至关重要。
搅拌罐式生物反应器是一种有前途的方法,可在受控的放大条件下产生足够的细胞数量。然而,它们并非为 MSC 扩增而量身定制或优化。必须考虑保持批次间标准化、细胞产量以及细胞因子和生长因子分泌,以便进行工业和临床转化。必须考虑微载体培养系统对 MSC 分泌蛋白组的影响,因为分泌蛋白组被认为是治疗功能的一个重要指标。一个悬而未决的问题是,MSC 分泌蛋白组是否会因放大生产系统而动态改变,不同于在 2D 培养系统中获得的分泌蛋白组。一种较新的技术,即垂直轮式生物反应器(见图2),可扩展至 500 L 培养体积,已在 HPL 添加培养基中针对脐带来源的 MSC (UC-MSC) 和 A-MSC 进行了评估,并针对静态 2D 培养进行了经济评估。我们发现,使用这种类型的生物反应器系统和微载体可以显著降低成本(在某些情况下可降低高达 50%)。使用垂直轮代替搅拌桨进行混合的另一个优点是可以降低剪切应力,因为剪切应力对细胞表型、分化能力和分泌组的影响在很大程度上是未知的。