产品中心
技术交流

扫描二维码
Nature报道胰腺癌新靶点!又是代谢!
本文来源于微信公众:芒果师兄 作者:草莓
2025年4月,Nature杂志发表题为Targeting PIKfyve-driven lipid metabolism in pancreatic cancer的研究论文。该研究发现,脂质激酶PIKfyve是胰腺导管腺癌PDAC的靶点;抑制PIKfyve可迫使PDAC依赖新生脂质合成,而联合阻断PIKfyve和KRAS–MAPK通路可在多种模型中清除肿瘤,展现其干扰脂质代谢作为PDAC治疗策略的潜力。

胰腺导管腺癌PDAC是最致命的癌症之一,五年生存率只有13%。其主要原因之一是缺乏有效的治疗方法。PDAC的肿瘤微环境是导致治疗失败的关键。PDAC组织里有大量的基质成纤维细胞和细胞外基质沉积,这让肿瘤内部血管很少,营养供应变得很困难。为了应对营养匮乏的环境,PDAC细胞通过细胞回收路径、表达高效能的营养物质转运蛋白,从周围环境抢夺营养物质,吞噬大块物质,并与周围其它细胞密切协作,共同获取营养物质。
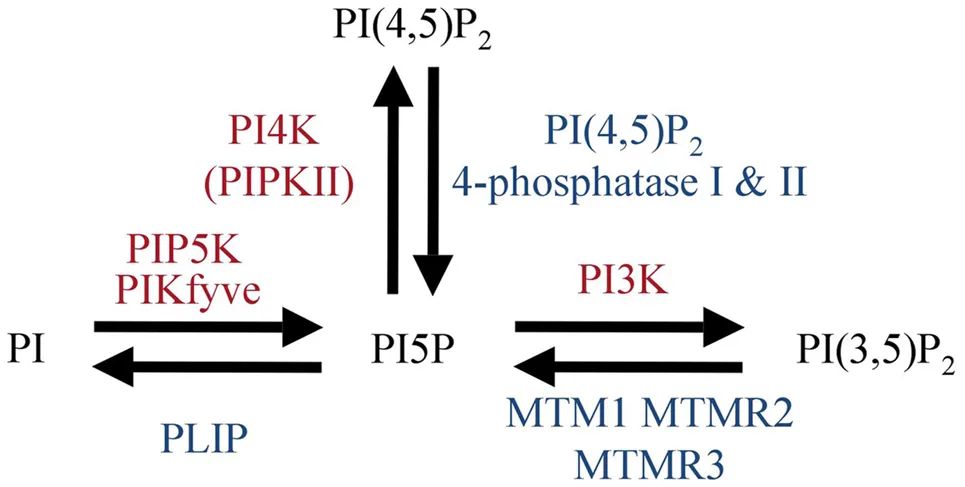
从本文可知,PDAC细胞非常依赖高水平的自噬和溶酶体功能来维持生存。早期研究显示,靶向这些代谢途径有治疗潜力,但开发新药的进展很慢,主要因为很难找到既有效又适合做药物靶点的分子。PIKfyve是一种在溶酶体功能中起关键作用的脂质激酶,可调节细胞骨架功能、膜运输和受体信号传导。人类拥有多种 PtdIns 蛋白,它们的区别在于肌醇环的磷酸化程度和位置,是PDAC可以被靶向的“弱点”。除了作为脂质激酶外,PIKfyve 还具有蛋白激酶活性。

PIKFYVE激酶是多种ALS类型的治疗靶点(简称ALS,即渐冻症)
主要实验方法。除了常规的生物学实验如Western blot(蛋白免疫印迹)/ qPCR(定量PCR)/免疫组化IHC和免疫荧光染色;组织学和病理分析如H&E染色;细胞生物学实验如细胞增殖和活力检测/ 细胞自噬流检测/ 代谢压力测试以外,主要是使用了动物实验,包括KPC基因工程小鼠模型/ 同种异体或人源异种移植模型(PDAC细胞移植到小鼠体内)/ 药物治疗和组织取材;靶向代谢组学(LC-MS/MS)/ 脂质组学分析和基因操作与分子干扰CRISPRi和siRNA/联合用药与合成致死实验。

作者用转基因小鼠模型证明,PIKfyve对PDAC的进展至关重要。通过代谢组学数据分析,研究人员发现当抑制PIKfyve时,PDAC细胞会被迫激活另一套应急程序,增强自身脂肪酸的合成。在PDAC细胞里,KRAS-MAPK信号通路正好就是调控脂质新生的核心“发动机”。因此,如果同时抑制PIKfyve和KRAS–MAPK通路,就能切断PDAC的所有生存后路,使肿瘤在多种小鼠和人源模型中显著消失。

为了探究PIKfyve对PDAC的作用,一步步验证PIKfyve的作用,分别验证了以下结论:1.Pikfyve在健康胰腺中没有重要用途。2.PDAC肿瘤的发生需要Pikfyve激酶。3.PIKfyve抑制剂减轻PDAC生长。4.PIKfyve驱动PDAC溶酶体功能,促进肿瘤细胞生存。5.PIKfyve抑制诱导脂肪生成。6.KRAS-MAPK通路驱动胰腺导管腺癌的脂肪生成。7.PIKfyve激酶可激活自噬。8.PIKfyve与KRAS–MAPK抑制剂有协同作用。

综合来看,该研究表明,通过抑制PIKfyve扰乱脂代谢、再联合KRAS–MAPK靶向药物,可以让胰腺癌细胞无处可逃,达到合成致死的效果,为胰腺癌治疗开辟了新途径。PIKfyve抑制剂ESK981目前正在进行多中心II期临床试验(NCT05988918),凸显出PIKfyve与KRAS-MAPK抑制剂联用策略在PDAC治疗领域极具前景,可能实现临床转化。