产品中心
技术交流

扫描二维码
文章来源公众号:试说新药 作者:方方同学
最近和几个做 CAR-T 的朋友聊天,大家都在讨论一个问题:现在做 in vivo CAR-T 的越来越多,TCE 临床数据也不错,传统 ex vivo CAR-T 会不会被取代?
这个问题值得好好掰扯一下。作为从业者,我们需要跳出各自的赛道,客观看看这三种技术路线到底有什么区别,各自适合什么场景。
先说清楚背景:为什么需要新方案?
传统的 ex vivo CAR-T 确实在临床上取得了突破性成功,但问题也很明显:
1. 制备周期长。从采集患者 T 细胞到回输,需要 16-33 天。对于进展快的患者,这个等待时间可能是致命的。
2. 产能受限。每个患者都要单独制备,只能靠建更多 GMP 车间来扩产能,无法像普通药物那样规模化生产。
3. 成本高昂。复杂的制备流程、专业设施、质控要求,导致治疗费用居高不下。
4. 需要淋巴清除预处理。化疗清除患者自身淋巴细胞,这个过程本身有风险,会导致长期免疫抑制、感染并发症,很多患者耐受不了。
5. 实体瘤疗效有限。在血液瘤之外,CAR-T 在实体瘤的表现一直不理想。
这些痛点催生了两个方向的探索:一个是 in vivo CAR-T,直接在体内把患者 T 细胞改造成 CAR-T;另一个是 TCE,用双特异性抗体把 T 细胞 “拉” 到肿瘤旁边激活它们,绕过基因改造这一步。
In vivo CAR-T:直接体内改造的优势与挑战
in vivo CAR-T 的核心思路是:既然体外制备这么麻烦,能不能把 CAR 基因或蛋白直接递送到患者体内的 T 细胞上?
目前主要有两种技术路线:
用脂质纳米颗粒(LNP)包载编码 CAR 的 mRNA,表面修饰抗 CD3/CD5/CD7 抗体来靶向 T 细胞。
优势很明显:
但问题也不少:
根据文献数据,CD3-LNP 递送 CD19 CAR mRNA 后,12 小时 T 细胞转导率约 15%,36 小时降到 7%,60 小时只剩 5%。CAR 表达持续时间很短,这意味着需要反复给药。有人说反复给药可以解决,但这又带来新问题:多次给药会不会产生免疫原性?长期安全性如何?这些都需要临床数据回答。
而且,目前还有个绕不开的问题 —— 脱靶转导。即使用了 CD3 抗体靶向,仍然会有不少 LNP 被肝脏、巨噬细胞摄取,而且如果肿瘤细胞表达了 CAR,反而会掩蔽抗原,这叫 “epitope masking”。
把慢病毒表面修饰上 CD3/CD8 靶向分子,携带 CAR 基因直接在体内转导 T 细胞。
这个方案能实现稳定的 CAR 整合和表达。在非人灵长类实验中,单次注射 CD3 靶向慢病毒后,65% 的 T 细胞表达 CD20 CAR,完全清除 B 细胞长达 76 天。
听起来很美好,但有个致命问题:体内随机插入突变的风险很难控制。
Ex vivo CAR-T 虽然也用慢病毒,但至少可以在体外做质控,筛选掉有问题的克隆。而体内转导是在活体内发生的,如果转导到生殖细胞、造血干细胞或其他不该转导的细胞,后果不可预测。特别是对于现在的大热门自免疾病,这种长期风险是难以容忍的,这也导致目前慢病毒没有LNP方案吸引人。
TCE:更简单但也更 “笨” 的方案
TCE(双特异性 T 细胞接合器)走的是完全不同的路线 —— 不做基因改造,用一个蛋白分子,一端结合肿瘤抗原,另一端结合 T 细胞 CD3,把 T 细胞 “拉” 到肿瘤旁边激活。
TCE 的优势:
TCE 的问题:
但注意,这些问题 in vivo CAR-T(非整合载体LNP)也都有!
LNP-mRNA 方案同样需要反复给药,停药后 CAR 表达消失,同样依赖抗原表达。两者在持久性上其实是半斤八两。
真正的区别在于:TCE 只是激活内源 T 细胞,而 in vivo CAR-T 能让 T 细胞表达 CAR 分子。理论上,CAR 的亲和力、特异性、信号传导可以优化,杀伤效率可能更高。但这个优势能否在临床体现,还需要数据说话。
客观比较:谁在哪些方面更强?
把三种方案的关键指标列个表: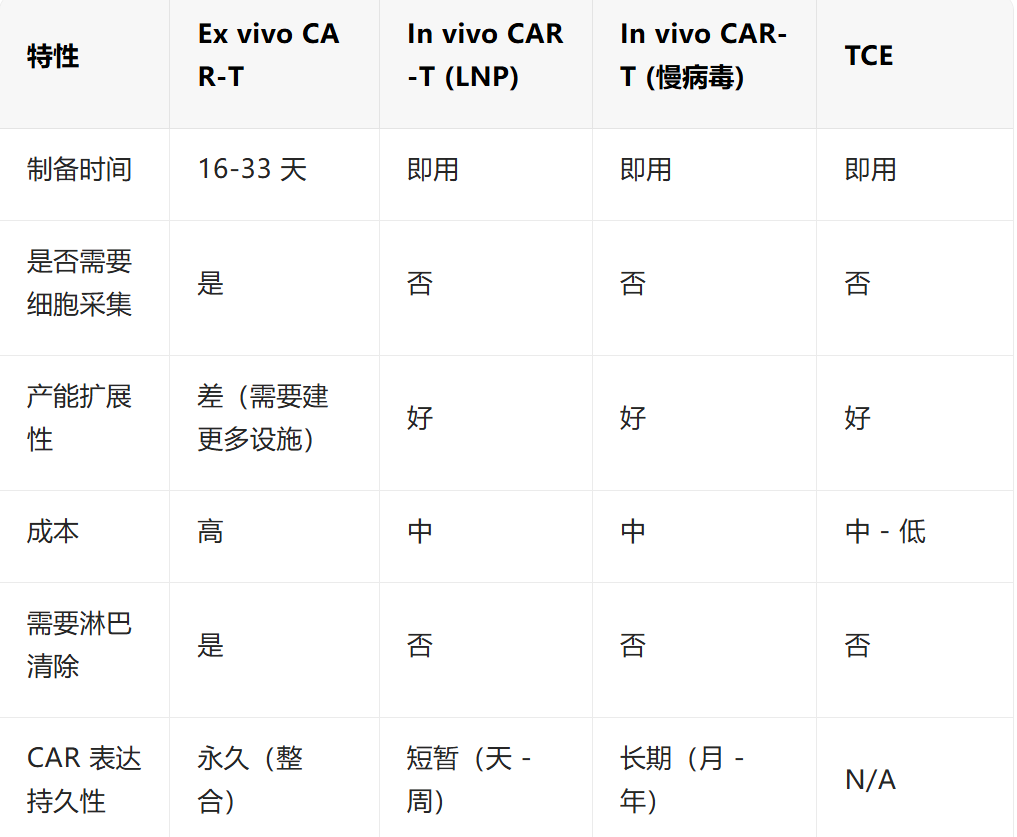
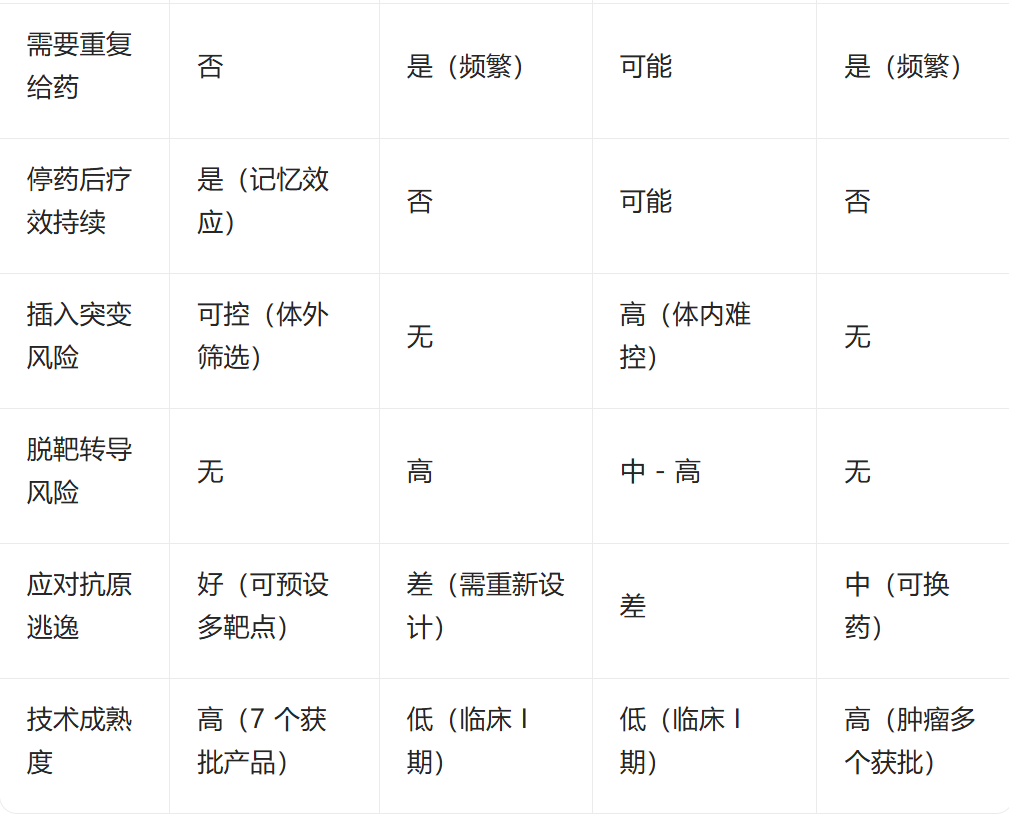 从这个表可以看出:没有一种方案在所有维度都占优。
从这个表可以看出:没有一种方案在所有维度都占优。
未来会怎样?
我的判断是:短期内,in vivo CAR-T 和 TCE 都不会完全取代 ex vivo CAR-T,而是适用于不同的场景和患者。这就像癌症治疗不是单一化疗或靶向药,而是根据分期、基因型、患者状况组合用药。免疫治疗可能也会走向这个方向(以下仅笔者个人见解,欢迎提出不同意见)。
Ex vivo CAR-T 最适合:
In vivo CAR-T(LNP-mRNA)可能适合:
TCE 最适合:
作为从业者,我们容易陷入 “技术竞争” 的思维,哪个技术更先进,哪个会取代谁。
但临床需求是多样的。有些患者需要快速缓解,有些需要长期控制;有些能耐受强化治疗,有些只能接受温和方案;有些追求治愈,有些只求生存延长。
没有一种技术能满足所有需求。
In vivo CAR-T 提供了新的可能性,但不是万能钥匙。它有独特优势(可及性、避免淋巴清除),也有明显局限(持久性、靶向性)。TCE 更成熟,但也有自己的天花板。
真正的 “终局” 可能是:不同技术在各自最合适的场景发挥作用,通过组合策略实现最优疗效。
对我们来说,重要的是理解每种技术的本质和边界,而不是盲目追逐热点。毕竟,最终评判标准只有一个:能否让患者获益。