产品中心
技术交流

扫描二维码
【ADC药物】2025年双靶点ADC药物重大事件一文梳理
文章来源公众号:Derek工作室 作者:Derek工作室
Bispecific antibody drug conjugates(双抗ADC): Making 1+1>2.

双抗ADC相比于单特异性ADC具有多方面优势,在抗体结构上,双抗ADC为对称或不对称结构,包括双表位ADC和双靶点ADC,抗体价态从双价到四价甚至更多,相比单特异性ADC针对单个抗原的传统双价IgG抗体结构,其选择性更强;在治疗效果上,单特异性ADC结构简单,可能产生脱靶效应,对低抗原表达率患者有效性差,而双抗ADC双重靶向扩大了适应症范围,有望提高治疗效果,降低耐药性问题;在毒副作用方面,单特异性ADC靶向单个抗原,若该抗原在健康组织中表达,会产生靶向非肿瘤毒性,双抗ADC同时靶向两种不同抗原,能促进抗原交联,减少靶向非肿瘤毒性;不过在设计和生产上,单特异性ADC相对容易,双抗ADC则因分子复杂性增加面临设计和生产挑战。
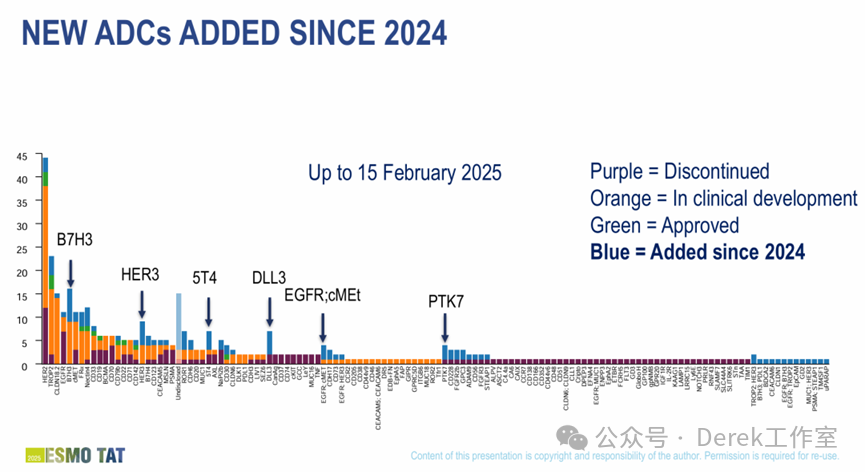
截至2025年,已有17种单特异性ADC获得批准,同时还有100多个ADC处于不同的临床试验阶段;与之形成对比的是,双抗ADC虽展现出良好潜力,但尚未有产品获批上市。全球范围内,进入临床阶段的双抗ADC共计19款,涵盖了多种不同的靶点组合,c-MET/EGFR(10款)、EGFR/HER3(4款)、FRa双表位(3款)、HER2双表位(3款)、B7H3/PSMA(2款)、PD-L1/TROP2(2款)、ROR1双表位(1款)。在这些进入临床阶段的双抗ADC中,研发进度差异明显,仅3款处于临床III期,1款处于临床II期,其中较为知名的有康宁杰瑞的JSKN-003和JSKN-016、百利天恒的BL-B01D1、正大天晴的TQB2102。
2025年2月:康宁杰瑞JSKN003获NMPA药品审评中心批准Ⅲ期临床试验
康宁杰瑞与石药集团联合宣布,双方合作开发的HER2双抗ADC药物JSKN003,针对HER2阳性晚期乳腺癌的Ⅲ期临床试验(研究编号:JSKN003-301)获国家药品监督管理局(NMPA)药品审评中心批准。该试验采用随机、对照、开放设计,以恩美曲妥珠单抗(T-DM1)为对照,主要评估无进展生存期(PFS),针对既往接受过含曲妥珠单抗方案治疗进展的HER2阳性晚期乳腺癌患者,进一步完善JSKN003在乳腺癌领域的临床布局。
2025年4月:康宁杰瑞JSKN016开展的Ⅰ期临床研究正式完成首例患者给药
全球范围内唯一一款HER3/TROP2双抗ADC药物JSKN016,在中国晚期恶性实体瘤患者中开展的Ⅰ期临床研究(研究编号:JSKN016-101)正式完成首例患者给药。该药物设计核心在于同时靶向HER3(人表皮生长因子受体3)与TROP2(人滋养层细胞表面抗原2)两大实体瘤高表达靶点——临床前研究显示,TROP2在肺腺癌、肺鳞癌、乳腺癌中的高表达率分别达64%、75%、78%,HER3过度表达则与肺癌、乳腺癌、胃癌等多种实体瘤的预后不良相关,二者协同靶向可扩大治疗覆盖范围,提升对单一靶点表达或双靶点共表达肿瘤的杀伤效果。
2025年6月:百利天恒BL-B01D1启动Ⅰ期临床研究
EGFR×HER3双抗ADC药物伊扎布伦(BL-B01D1),启动在携带经典EGFR突变以外驱动基因改变(GA)的局部晚期或转移性非小细胞肺癌(NSCLC)患者中的Ⅰ期临床研究,旨在探索药物的安全性、耐受性及初步疗效。
2025年7月:正大天晴TQB2102纳入“突破性治疗品种”
国家药品监督管理局药品审评中心(CDE)公示,HER2双抗ACD药物TQB2102拟纳入“突破性治疗品种”,适应症为“HER2阳性早期或局部晚期乳腺癌的新辅助治疗”,标志着其在早期乳腺癌治疗中的临床价值获权威认可;同期,正大天晴在CDE登记TQB2102的Ⅲ期临床试验(CTR20251922),该研究为头对头设计,对比罗氏恩美曲妥珠单抗(T-DM1),评估其在“既往接受过抗HER2单抗+紫杉类药物治疗”的HER2阳性不可切除局部晚期/转移性乳腺癌患者中的疗效与安全性,成为TQB2102继HER2低表达乳腺癌后启动的第二项Ⅲ期研究,强化其在乳腺癌治疗领域的布局。
2025年7月:康方生物AK146D1晚期实体瘤的Ia期临床试验中完成首例患者给药
康方生物自主研发的Trop2/Nectin4双抗ADC药物AK146D1,在治疗晚期实体瘤的Ia期临床试验中完成首例患者给药。作为康方生物首个进入临床阶段的双抗ADC药物,AK146D1此前已获美国FDA、澳大利亚TGA及中国国家药监局批准开展临床试验,目前正在中国、澳大利亚等地高效推进研究。
2025年7月:康宁杰瑞JSKN003获美国食品药品监督管理局(FDA)两项重要认定/批准
JSKN003获美国食品药品监督管理局(FDA)两项重要认定/批准:一是获批开展针对铂耐药复发性上皮性卵巢癌、原发性腹膜癌或输卵管癌的Ⅱ期临床研究(研究编号:JSKN003-202),进一步推进该药物在全球PROC治疗领域的临床开发;二是获FDA“孤儿药资格认定”,用于治疗胃癌及胃食管结合部癌(GC/GEJC),未来在美研发、注册及商业化可享受政策支持。
2025年7月:百利天恒BL-B01D1全球首个完成Ⅲ期研究
百利天恒宣布,其自主研发的全球首创EGFR/HER3双抗ADC药物伦康依隆妥单抗(BL-B01D1),在治疗鼻咽癌的关键Ⅲ期临床试验(BL-B01D1-303)期中分析达到主要终点,该适应症针对既往经PD-1/PD-L1单抗治疗且经至少两线化疗(至少一线含铂)治疗失败的复发性或转移性鼻咽癌患者,该药也成为全球首个完成Ⅲ期研究的双抗ADC药物,正式叩响上市大门。
2025年9月:百利天恒公布izalontamabbrengitecan的Ⅱ期临床数据
在世界肺癌大会(WCLC)上,百利天恒与百时美施贵宝(BMS)联合公布izalontamabbrengitecan的Ⅱ期临床数据:该药物与EGFR抑制剂Tagrisso联合作为一线疗法,治疗携带EGFR突变的非小细胞肺癌(NSCLC)患者时,客观缓解率(ORR)达100%,确认ORR为95%,12个月无进展生存率达92.1%,展现出显著临床获益。
2025年9月:Avenzo Therapeutics的AVZO-1418完成Ⅰ/Ⅱ期临床试验首位患者给药
Avenzo Therapeutics与映恩生物联合开发的EGFR/HER3双抗ADC药物AVZO-1418,完成Ⅰ/Ⅱ期临床试验首位患者给药,该研究针对晚期实体瘤患者开展,旨在评估药物的安全性、耐受性、药代动力学特征及抗肿瘤活性。
2025年9月:百奥赛图IDE034披露临床前进展与研发规划
百奥赛图合作伙伴IDEAYABiosciences在德国柏林举办的十周年研发日上,重点披露双方合作的B7-H3/PTK7双抗ADC药物IDE034(又称BCG034)的临床前进展与研发规划,该药基于百奥赛图RenLite®全人抗体共轻链平台开发,搭载专有连接子-载荷系统,计划覆盖多类实体瘤适应症。