产品中心
技术交流

扫描二维码
再看mRNA-LNP的体内CAR-T路线:不可忽略的“佐剂”效应
文章来源公众号:大鱼科学 作者:大鱼科学
细胞治疗领域正面临多条技术路径的比较——“通用型”与“体内制备”之争,以及“病毒载体”与“LNP递送”之选。其中,基于LNP递送mRNA在体内生成靶向CD19 CAR-T的研究,已率先进入临床试验阶段,并显示出一定的B细胞清除效果。尽管该技术的作用机制看似仅是对体外CAR-T制备方式的简单转换,但最新研究提示,采用mRNA-LNP技术路线时,可能需要额外考量一个潜在因素——mRNA本身所具有的佐剂效应。
01
一项回顾性研究分析了接受免疫检查点抑制剂治疗的黑色素瘤或非小细胞肺癌患者。结果显示,在ICI治疗启动后100天内接种新冠mRNA疫苗的患者,其肿瘤治疗反应及生存期均显著改善(图1)。尤其在非小细胞肺癌患者中,接种疫苗组的中位生存期从20.6个月延长至37.3个月。
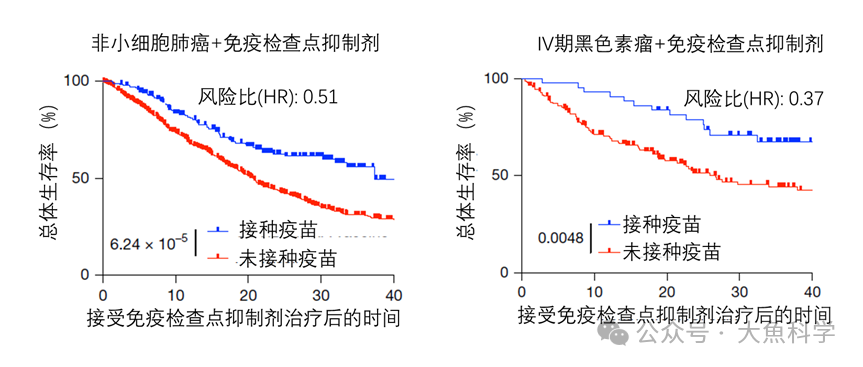
图1. 新冠mRNA疫苗接种与肿瘤患者生存期的关联分析。在接受免疫检查点抑制剂(ICI)治疗100天内接种新冠mRNA疫苗的患者(蓝色曲线)展现出更高的总体生存率。
02
研究人员在小鼠模型中成功复现了这一临床现象:新冠mRNA疫苗与ICI联用可显著延缓肿瘤进展。该协同效应与干扰素α水平升高(图2A)、脾脏及淋巴结中肿瘤抗原递呈细胞数量增加(图2B),以及脾脏和肿瘤组织中肿瘤特异性T细胞扩增(图2C)密切相关,且在多种肿瘤类型中均观察到类似效果。
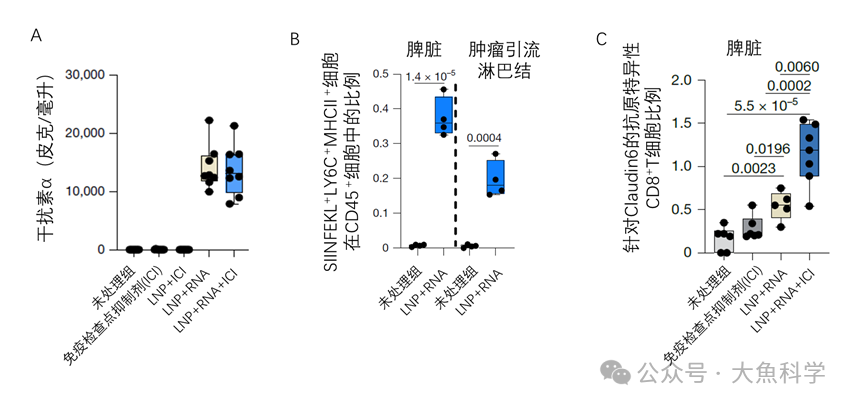
图2. mRNA-LNP诱导的系统性抗肿瘤免疫应答(小鼠模型)。mRNA-LNP注射可显著提升干扰素-α分泌水平(A),增加肿瘤抗原递呈细胞数量(B),并促进肿瘤特异性T细胞的扩增(C)。
值得注意的是,新冠mRNA疫苗本身并不引发肿瘤特异性T细胞的交叉反应。因此,上述现象实际反映了mRNA疫苗对抗肿瘤免疫的系统性增强——涵盖天然免疫与适应性免疫、涉及外周淋巴组织与肿瘤微环境。这一发现也与作者此前关于脾脏内存在抗肿瘤免疫调控的观察相吻合。
03 无论靶点、形式如何,当采用LNP-mRNA作为载体在体内生成CAR-T或CAR-NK细胞时,其对天然免疫和适应性免疫的系统性调控作用依然存在。 这是一把双刃剑:对肿瘤患者而言,广泛激活抗肿瘤免疫无疑具有积极意义;然而对于自身免疫性疾病患者,mRNA疫苗所诱导的干扰素水平升高、T细胞广泛活化等现象,是否会导致额外的不良事件、并干扰靶向细胞的清除效果,仍有待明确。 正在进行的针对系统性红斑狼疮的LNP-mRNA CAR-T临床试验,或许将为这一问题提供更多线索。