产品中心
技术交流

扫描二维码
生物制药抗药抗体(ADA)的检测与分析方法
文章来源公众号:梓树艺药荟 作者:梓树zishu
摘要:
基于抗体的治疗剂和其他生物制药现在用于治疗许多疾病。然而,当这些生物药物给患者服用时,可能会发生免疫反应,从而降低药物的疗效并导致不良副作用。生物制药的免疫原性可以通过检测和测量针对这些药物产生的抗体或抗药抗体(ADA)来评估。ADA检测和分析方法在选择基于此类药物的治疗方法时可能很重要,并且在开发和测试新的生物制药时也至关重要。本综述研究了用于ADA检测、测量和表征的方法。其中许多方法基于免疫测定和抗原结合试验,包括均匀迁移率转移测定。其他用于分析ADA的技术包括毛细管电泳、报告基因测定、表面等离子体共振光谱和液相色谱-质谱法。将讨论每种方法的一般原则,以及它们在ADA分析方面的最新应用。
【NO.1】简介
1.1.生物制药和治疗性单克隆抗体
近年来,基于抗体、蛋白质或相关生物制剂的生物制药已变得普遍。例如,第100种单克隆抗体(mAb)产品最近获得了美国食品和药物管理局(FDA)的批准。仅在2020年,美国FDA就批准了13种mAb用作治疗剂。基于抗体的生物制药现在构成了治疗市场的重要组成部分,近年来大多数最畅销的药物都是基于单克隆抗体的。阿达木单抗(Humira,来自艾伯维)、英夫利昔单抗(Remicade、Johnson)、利妥昔单抗(Rituxan、Roche)和派姆单抗(Keytruda、Merck)都是用于此目的的单克隆抗体。
单克隆抗体的靶标特异性使这些药物作为治疗其他疑难杂症(如各种癌症和自身免疫性疾病)引起了人们的极大兴趣。通过重组技术,还可以定制单克隆抗体的许多特性,例如它们的亲和力、大小和一般结构。然而,由于单克隆抗体和其他生物制药是人造的,对人体有害,因此这些药物在给患者服用时有可能引起免疫反应。尽管并非所有免疫应答病例都可能导致不良反应,但免疫原性的发展可导致生物制药疗效丧失。随着时间的推移,这可能意味着需要增加生物制药的剂量,或者如果发生更严重的免疫反应,可能不得不停用该药物。
通过分析抗药抗体(anti-drugantibodies,ADAs)可以检测生物制药(如单克隆抗体)的免疫应答。例如,ADA的出现是单克隆抗体(如阿达木单抗)治疗失败的已知因素,单克隆抗体(如阿达木单抗)与肿瘤坏死因子α(TNF-α)结合并抑制肿瘤坏死因子α(TNF-),这可以通过药物-ADA复合物的形成和药物活性的中和而发生。这些影响导致对灵敏、精确和可靠的ADA检测的需求不断增加。现在有许多方法可用于检测、测量和表征ADA。本综述将描述ADA检测或分析中使用的各种技术,并讨论每种方法的应用。
1.2.抗体和单克隆抗体的一般性质
抗体是免疫系统响应外来物质或抗原产生的糖蛋白。典型抗体的基本结构,以免疫球蛋白G(IgG)为代表,由两条相同的长(或“重”)多肽链和两条较短(“轻”)多肽链组成,它们通过二硫键连接成“Y”形(见图1)。该结构的两个上臂包含抗体的片段抗原结合(Fab)区域,这是抗体具有可以选择性地与其给定靶标结合的位点的地方。抗体的下茎称为片段可结晶(Fc)区域。该区域的功能是介导抗体与免疫系统其他组分之间的相互作用。

图1 抗体的一般结构,如使用IgG所示,以及抗体的主要类别或同种型(例如IgG、IgM和IgA)的示例。
抗体属于免疫球蛋白(Ig)超家族,可分为五个常见类别(或同种型):IgA、IgD、IgE、IgG和IgM(示例见图1)。IgD、IgE和IgG类抗体以单体形式表达,而IgM在体内以基本Ig结构的五聚体形式存在,IgA通常以二聚体形式存在。这些类中的每一个都有不同的功能。例如,IgM是免疫应答早期血液中产生的最丰富的抗体类型,随着对外来物质的免疫建立,IgG是循环系统中的主要Ig类别。
单克隆抗体是由单个克隆细胞系产生的抗体。这组抗体既可作为基于抗体的检测试剂,也可作为生物治疗剂,因为它们具有明确的结合强度和对其靶抗原的特异性。与此相反,通常由免疫系统产生的抗体具有高度异质性,由免疫系统中的许多细胞系产生,从而产生一种被称为“多克隆抗体”的混合物。在开发用于治疗的单克隆抗体时,免疫球蛋白同种型是经过精心挑选的,例如在治疗中使用期间为药物提供相对较长的半衰期。在实践中,IgG类抗体是用于生产治疗性单克隆抗体的最常用的免疫球蛋白形式。
单克隆抗体在人体内的免疫原性水平与抗体的修饰水平有关。第一代mAb是通过Kohler和Milstein的杂交瘤技术创建的,该技术涉及小鼠骨髓瘤细胞与B淋巴细胞融合以产生小鼠mAb。尽管鼠mAb作为生化研究的试剂很有价值,但它们在人类中的免疫原性限制了其治疗效用。后来发现,与人抗体相比,与人抗体结构差异较小的人类或人源化单克隆抗体诱导的免疫反应低于鼠单克隆抗体。目前已经开发出几种类型的类人或人源化单克隆抗体。例如,将小鼠来源的可变区域与人类抗体的恒定区域相结合,将产生“嵌合”单克隆抗体。在“人源化”单克隆抗体中,除抗原识别区域外,鼠抗体的所有部分都已被人类对应物取代。在“全人源化”单克隆抗体中,抗体的所有部分均来自人类,不含来自其他物种的任何部分。
1.3.抗药抗体
免疫原性是指宿主对外来物质(如治疗性单克隆抗体)的免疫反应。对于生物治疗药物,这种反应反映在免疫系统产生ADA上。针对生物治疗药物的ADA的形成可导致患者治疗期间的不良反应,例如清除率增加和对药物过敏。第一代生物制药中使用的鼠单克隆抗体的成功率较低(~3%),证明了免疫原性可能引起的影响。然而,研究还发现,这种免疫反应可以通过重组DNA技术和噬菌体展示方法设计具有更类人结构的单克隆抗体来介导。使用通过这些方法制成的人源化单克隆抗体已将这些生物治疗药物的平均成功率提高到25%。
ADA的存在和水平现在被认为是生物治疗药物(如mAb)衡量免疫原性的指标。此外,ADAs会影响其靶药的药效学和药代动力学,从而降低该药物的疗效。在某些情况下,ADAs可对慢性病患者造成严重不良反应。ADA可分为两大类:中和和非中和。中和ADA可以直接阻断和干扰生物治疗剂的功能活性,使其与所需靶标结合。非中和ADA(或“结合性”ADA)与生物治疗剂结合,但结合的区域不会影响药物与靶标的结合能力。在临床环境中,中和ADA通常被认为更重要,因为它们直接影响药物的生物活性,但非中和ADA也可能间接降低药物的疗效。
作为一个具体的例子,已知在患者使用αTNF拮抗剂的生物治疗药物后可以产生ADA。这组药物包括英夫利昔单抗和阿达木单抗,用于治疗慢性炎症性疾病(如类风湿性关节炎、银屑病关节炎和克罗恩病)。TNF-α拮抗剂通过靶向TNF-α并抑制其与TNF-α受体的结合来减少炎症反应。中和ADA可以直接干扰TNF-α拮抗剂与其靶分子(即TNF-α)的结合,从而直接阻止药物的生物活性。非中和ADA会通过损害药物的生物利用度并改变药物从循环中的清除率来间接降低同一药物的疗效,例如通过形成ADA药物免疫复合物。
【NO.2】抗药抗体的免疫测定和结合测定
开发具有高灵敏度、精密度和特异性的ADA检测方法对于生物制药的质量控制和检查这些药物治疗患者至关重要。其中许多方法基于免疫测定。免疫测定是利用抗体或抗体相关试剂来鉴定或测量目标分析物的分析技术。抗体与其抗原的强结合使得免疫测定可用于选择性检测其靶标,即使在复杂的生物样本(如血清、血浆、尿液、组织和血液)中也是如此。
通过免疫测定法检测和定量分析物是通过使用可与其中一种测定组分偶联并在适当的水平上监测以测量目标来完成的。免疫测定中最常用的标记物是酶、荧光标签、化学发光标记和放射性同位素。这些标记物可以与抗体-抗原结合一起使用,具有竞争性或非竞争性以及同质或异质形式。如果以其中一种形式使用抗体或抗原以外的生物制剂,则结果有时会被赋予更通用的名称“结合测定”。本节讨论了用于测量或检测ADA的免疫测定和结合测定的具体示例。
2.1.抗原结合试验
抗原结合试验(ABT)是一种结合测定,已用于评估生物制药的免疫原性。在ABT中,抗体或其相应的抗原被固定化并用于捕获其相应的结合伙伴或靶分析物。该测定中可以加入各种类型的标记,以产生用于检测或确定捕获分析物量的信号。
这种测定的一种形式是pH-shift-anti-idiotypeantigenbindingtest(或PIA),如图2所示。该方法首先利用酸解离步骤从与这些抗体结合的任何药物中释放ADA;然后中和该溶液并添加可以与药物结合的F(ab)片段以防止药物与ADA重新结合。然后将ADA和药物都吸附到含有固定化蛋白A的载体上,该载体可以与ADA(例如,来自IgG的各个亚类)结合,并通过其Fc区域与药物结合。然后加入标记的药物F(ab)2部分以结合并检测捕获的ADA。该方法已与125份I标记的F(ab)2部分阿达木单抗一起使用,以测量这种基于mAb的药物存在下的ADA。
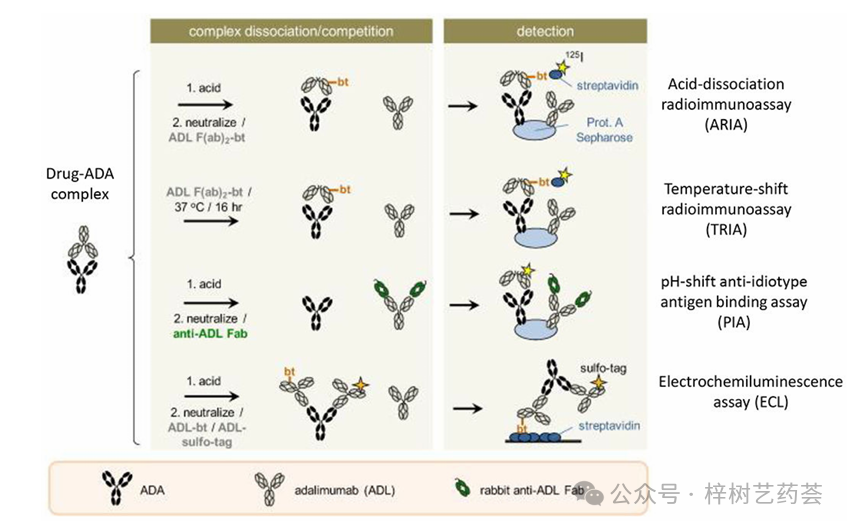
图2 用于分析ADA与基于mAb的生物制药的四种免疫测定或结合测定的示例。这些方法通过使用阿达木单抗作为感兴趣的药物来说明。
2.2.电化学发光测定
在基于电化学发光(ECL)的结合测定中,通过使用施加的电位产生来自化学标签的光来产生信号。标签通过氧化/还原反应达到激发态,然后通过发光将激发态弛豫为较低能态。这种类型的检测已被用于ADA检测,方法是使用钌标记(例如,三(联吡啶)钌(II)或[Ru(bpy)3]2+)。在这种方法中,允许样品中的ADA与含有两种标记的靶单克隆抗体药物形式结合:生物素和钌。然后让ADA与标记药物的桥接复合物吸附到含有固定链霉亲和素的金板上,该金板可以与生物素标签结合。然后测量吸附络合物及其相关钌标签的ECL信号。
在一项研究中使用了ECL结合测定,其中针对五种基于mAb的药物的多克隆和亲和纯化抗体用作模型ADA。将这些抗体的样品与生物素和钌偶联形式的药物一起孵育,然后用钌标签测量发光。使用酸解离步骤的这种方法的一般方案如图2所示。在低至5-64μg/L的水平和较宽的动态范围内(即10-10000μg/L)检测到给定药物的ADA。磺化形式的钌偶联物(即有助于提高水溶性的磺基标签)也被用于具有ECL检测的ADA测定。
在ECL检测测定中,已经探索了一种同时使用药物-ADA复合物的沉淀和酸解离的策略来检测ADA。在该方法中,通过添加过量的相应单克隆抗体药物形成免疫复合物来饱和样品中的ADA,然后使用聚乙二醇沉淀这些复合物。然后在酸性条件下将药物和ADA从复合物中释放出来,并吸附到板上进行检测。接下来,将磺基标记形式的药物应用于与固定化的ADA结合并产生由于ECL的信号。与仅使用酸解离的ECL桥接免疫测定相比,这种形式对高药物浓度的耐受性有所改善,ADA的回收率更高。
在免疫测定法中进行了结构域特异性检测,并ECL检测ADAs与moxetumomabpasudotox(即具有两个特异性结构域的重组抗CD22免疫毒素)。该测定基于在生物素化形式的药物(即用于捕获ADA)和药物的钌酰化标记形式(用于ECL检测)存在的情况下,具有和不具有含结构域分子的结构域特异性ADA的竞争性结合。信号抑制是由于结构域特异性ADA与含结构域分子结合而发生的。该测定允许在存在更显性的结构域特异性ADA的情况下检测低丰度的结构域特异性ADA。
2.3.放射免疫测定
放射免疫测定(RIA)是一种使用放射性同位素作为标记物检测分析物的免疫测定。碘-125是一种常见的放射性同位素,在RIA中用作标记。尽管使用这种标签可以提供较低的检测限,但在使用放射性同位素作为标签时也需要考虑安全性、处理和标签存储方面的问题。其他需要考虑的因素包括使用放射性标记时标记的结合剂可能变性以及随着时间的推移最终信号丢失。
一些研究使用RIAs分析ADA。药物-ADA免疫复合物的酸解离已与RIA一起使用,以克服当存在此类免疫复合物时可能发生的对ADA的低估。这种方法被称为酸解离放射免疫测定(acid-dissociationradioimmunoassay,ARIA)。如图2所示,在ARIA中,允许针对靶标生物制药的未结合ADA与针对此类抗体的生物素化F(ab')2片段结合,然后免疫复合物的酸解离是样品,然后中和溶液。然后使用含有蛋白质A的载体捕获该混合物中产生的F(ab')2-生物素-ADA复合物,该载体用于与ADA或基于mAb的药物的Fc区域结合。然后通过添加125个I标记的链霉亲和素来检测也与生物素化F(ab')2片段结合的捕获的ADA,该链霉亲和素与生物素标签结合。
其他形式的RIA也已用于ADA的分析。例如,在针对阿达木单抗的ADA的温移RIA(TRIA)中使用了与PIA类似的方法。该方法(见图2)使用可与ADA结合的生物素化F(ab')2片段,以取代ADA测定中酸化步骤的需要,该测定将在目标药物(即阿达木单抗,在本例中为阿达木单抗)存在下进行。另一份报告采用液相RIA联合亲和色谱法测定患者样本中英夫利昔单抗和阿达木单抗的ADA水平。在这项工作中,通过使用含有抗人免疫球蛋白λ链抗体的载体来分离放射性标记英夫利昔单抗的游离形式和抗体结合形式。
2.4.酶联免疫吸附测定
酶联免疫吸附测定(ELISA)是用于检测和测量ADA的最常见免疫测定类型。为此,使用ELISA的优点包括灵敏度高、成本低、易于使用和通量相对较高。有多种ELISA格式可用于ADA检测,例如直接、间接和桥接(或夹层)方法。
2.4.1.直接和间接ELISA
直接检测形式是最简单的ELISA类型。当用于分析ADA时,这种形式涉及将样品中的ADA固定(例如,通过吸附或共价附着)到ELISA板上。接下来,将含有酶标记的二抗(如辣根过氧化物酶(HRP)或碱性磷酸酶)添加到板中,并使其结合固定化的ADA。然后添加适合酶标记的底物以产生与存在的ADA量成正比的信号。作为替代方法,生物素可用于标记捕获的ADA,然后与链霉亲和素偶联酶结合;然后,该酶标记随后与其底物结合,产生与捕获的ADA数量相关的信号。
这种方法的一个例子是基于亲和捕获洗脱(ACE)的直接ELISA,该方法用于检测针对基于mAb的药物bamlanivimab的ADA。使用酸解离步骤分解样品中的ADA-药物复合物,然后在固相载体上使用靶药来捕获游离或释放的ADA。然后通过采用第二个酸解离步骤将捕获的ADA从载体中洗脱出来。然后让洗脱的ADA吸附到ELISA支持表面上,并在添加生物素化形式的药物、HRP标记的链霉亲和素和HRP底物后进行检测。研究发现,在单克隆抗体药物过量1000倍的情况下,这种直接ELISA形式可以检测到低至500ng/mL的ADA。
尽管直接ELISA简单易行,但使用这种方法检测和测量ADA确实有几个缺点。首先,将ADA固定在ELISA板上会导致这些抗体的构象发生变化,并掩盖其结构中的某些区域;这种掩蔽可能会阻碍这些捕获的药物与二级结合剂的结合。此外,由于ADA固定在ELISA载体或板上的固定性通常不具有特异性,因此样品中的其他蛋白质可以与该载体/板结合,并可能导致高背景信号。
在ADA的间接ELISA中,在固定ADA后将原始生物制药剂添加到ELISA板中。然后将该抗原的二级形式的酶标记形式添加到板中。这形成了标记的免疫复合物,可以产生与板上ADA数量成正比的信号。间接ELISA的一个关键特征是需要物种特异性二抗原进行检测,当动物血清用作检测人血清中ADA的阳性对照时,该项目可能是一个问题。然而,桥接ELISA(如下一节所述)可用于克服这个问题,并允许检测任何同种型或物种的抗体。
2.4.2.桥接ELISA
桥接ELISA使用两种结合剂(如靶药)与ADA上的不同区域相互作用(见图3)。其中一种结合剂涂在ELISA板上,用于捕获ADA。然后将含有酶标记的第二种结合剂添加到混合物中,使其与捕获的ADA结合,并产生检测信号。
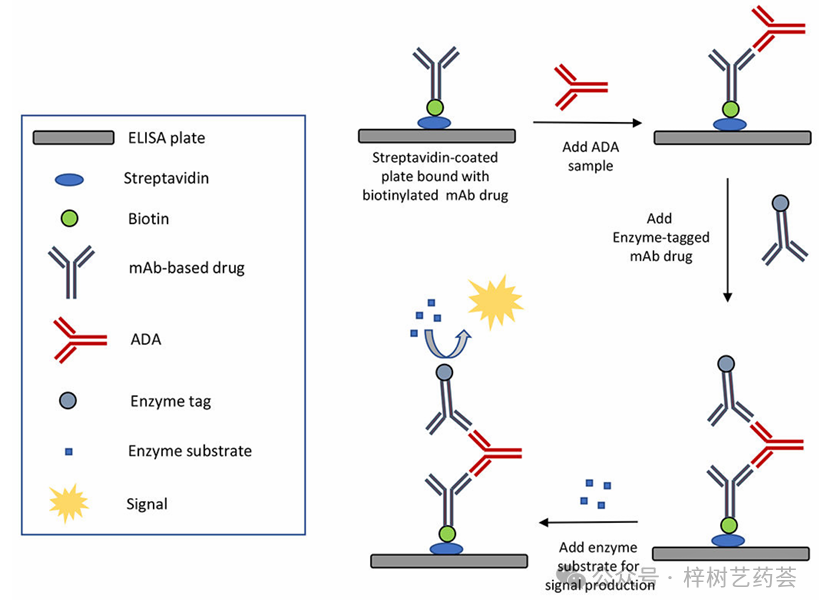
图3 用于ADA检测的桥接ELISA中的一般方案
使用对ADA上不同区域特异性的两种结合剂,使桥接ELISA比直接和间接ELISA格式更具特异性,这一功能在处理复杂样品时非常有用。与直接和间接ELISA相比,桥接ELISA的其他优点是灵敏度高,不需要物种特异性抗体作为试剂。此外,该方法比直接和间接测定形式更能耐受循环药物的浓度。由于这些优点,桥接ELISA是目前用于检测ADA的最常用ELISA格式。
然而,桥接ELISA也有缺点。例如,这种类型的测定比直接或间接ELISA方法更复杂,因为它对ADA上的不同区域使用两种结合剂。此外,桥接ELISA格式可能无法检测低亲和力ADA和单价抗体。尽管这种形式对循环药物的存在具有很强的耐受性,但它仍然容易受到高浓度这些药物的干扰。当该方法与固相萃取和酸解离相结合时,可以在一定程度上减少药物干扰问题。后一种方法依赖于这样一个事实,即抗体和固定化抗原之间形成的复合物通常比抗体和可溶性抗原之间形成的复合物或存在于抗体-抗体复合物中的复合物更稳定
桥接ELISA已用于检测针对各种生物制药和单克隆抗体药物的ADA;例如,促红细胞生成素、干扰素β、美妥珠单抗、阿达木单抗、英夫利昔单抗和Eternacept的ADA检测。使用桥接ELISA测定法检测针对美妥珠单抗的抗体,方法是将一些药物放在微量滴定板上以捕获针对该药物的ADA。然后加入HRP标记的美妥珠单抗,并与显色底物(3,3',5,5'-四甲基联苯胺或TMB)一起使用,以提供0.39ng/mL的检测限和0.39-50ng/mL的线性范围。在另一项研究中,桥接ELISA用于检测针对基于单克隆抗体的药物MAB072的IgE类ADA。这项工作使用涂有人IgE受体FcεRIα的板从血清样本中捕获IgE类ADA。然后加入生物素化形式的MAB072并使其与捕获的IgE类ADA结合,然后加入链霉亲和素标记的HRP和TMB作为显色底物进行检测。另一项研究使用桥接ELISA将共价偶联的高密度抗原表面与酸解离相结合,以尽量减少ADA与基于mAb的化疗药物分析过程中高药物浓度的干扰。此外,桥接ELISA与基于生物素-亲和素系统的固相提取和酸解离预处理相结合,从基于mAb的药物中分离和测量ADA和药物结合的ADA。
越来越多的生物治疗药物含有工程序列或多个功能结构域。一项研究使用基于ELISA的测定法检测ADA并表征双特异性F抗体片段的免疫原性部分。该方法将间接桥接ELISA与分子工程方法相结合,该方法使用基于药物变体的多种结构域检测测定。雷珠单抗是一种抗VEGF抗体药物,在恒定区域没有突变,用作测定的对照。结果表明,ADA主要针对药物的两个抗原结合位点。此外,该方法可以区分针对单克隆抗体药物的一个或两个抗原结合位点的抗体和恒定结构域区域。
近年来,已经开发了桥接ELISA格式,用于测量免疫复合物而不仅仅是游离ADA,或用于分析ADA和免疫复合物。例如,使用桥接ELISA测量在接受阿达木单抗治疗的小鼠血浆中发现的循环ADA-人IgG免疫复合物。在该测定中,将多克隆山羊抗人IgG固定在ELISA板上,并用于捕获样品中存在的ADA-人IgG复合物。接下来,加入HRP标记的山羊抗小鼠IgG和HRP底物进行检测。在一项类似的研究中,酸解离与桥接ELISA和色谱法一起使用,采用尺寸排阻支持来定量和表征药物-ADA免疫复合物。将针对靶药互补决定区(CDR)的生物素化mAb固定在链霉亲和素包被的板上,并用于从样品中捕获药物-ADA免疫复合物。随后加入地高辛标记的单克隆抗体对抗药物的CDR,然后加入HRP标记的抗地高辛F抗体片段,并使用3-(4-羟基苯基)丙酸作为HRP底物进行基于荧光的检测。
2.5.均匀迁移率转移测定
均质迁移率位移测定(HMSA)是一种将配体结合测定与尺寸排阻色谱(SEC)相结合的方法。SEC是一种色谱技术,可以根据目标化合物的相对大小和形状来分离目标化合物。这种分离是通过使用含有多孔载体的色谱柱进行的。由于较小的靶标将能够进入更多的载体孔体积,因此它们比较大的化合物更晚从色谱柱中洗脱出来。在HMSA方法中使用SEC可以区分不同大小的ADA同种型,例如基于IgG、IgM或IgA的同种型。
HMSA的一般方法如图4所示,如该方法在检测和基于大小分离人血清中ADA与英夫利昔单抗的应用。在本报告中,使用酸解离步骤从ADA-药物复合物中释放ADA。然后将含有释放的ADA的溶液中和,并与荧光标记的英夫利昔单抗(即使用AlexaFluor488标签)和一种活性位点阻断的药物形式的混合物孵育,后者用作内标。为了测量样品中英夫利昔单抗的浓度,遵循相同的程序,但现在添加了AlexaFluor488标记的TNF-α,并且没有酸结合步骤。将该方法的结果与桥接ELISA的结果进行了比较。研究发现,在血清中存在高浓度(60ug/ml)英夫利昔单抗的情况下,该方法可以检测到低至0.036ug/mlADA。
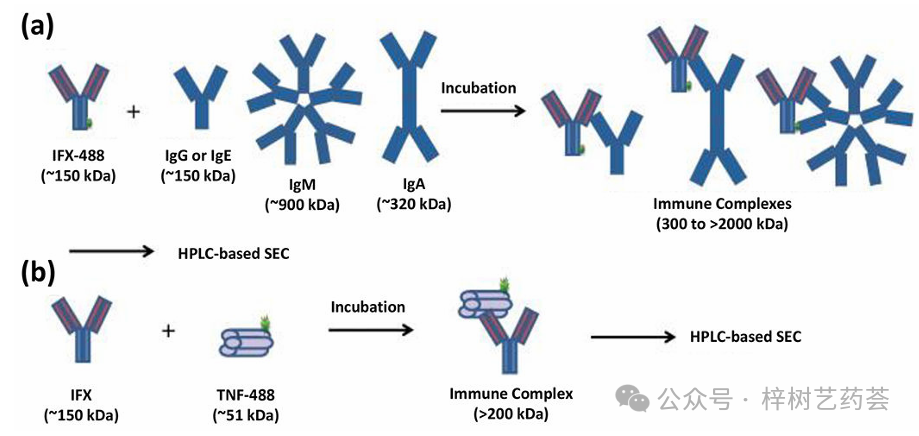
图4.当用于(a)检测给定药物的ADA或(b)母体药物时,使用英夫利昔单抗(IFX)和AlexaFluor488标记的药物(例如IFX-488)在本例中。TNF-488代表AlexaFluor488标记的TNF-α。
其他类型的ADA和生物制药(如阿达木单抗)也采用了相同的方法。例如,使用HMSA鉴定并分离了阿达木单抗和11种不同ADA的二聚体和多聚体免疫复合物。据报道,使用HMSA可以将中和ADA与阿达木单抗和英夫利昔单抗处理样品中的其他成分区分开来。在HMSA中中和抗体的检测与另一种基于亲和力捕获和洗脱的测定中发现了相关性。ELISA也进行了类似的比较。HMSA还被用于鉴定基于mAb的药物那他珠单抗和优特克单抗的ADA。
开发了一种改良的竞争性结合形式的HMSA来测量存在同类药物的蛋白质疗法。以阿达木单抗为模型药物,并定量了阿达木单抗的血清浓度。将含有英夫利昔单抗作为相关药物的血清样品与荧光标记的阿达木单抗混合,然后将ADA添加到阿达木单抗中,并使用1小时孵育步骤以形成免疫复合物。HMSA的SEC组分用于区分游离药物(摩尔质量,~150kDa)和阿达木单抗-ADA二聚体(~300kDa),并使用ELISA验证HMSA方法。