产品中心
技术交流

扫描二维码
Nature系列万字综述| CAR-T细胞的小分子调控
文章来源公众号:南风夜谈 作者:南风夜谈编

嵌合抗原受体(CAR)T细胞疗法是一种“活药物”,在该疗法中,患者的T细胞经过基因工程改造,表达一种人工受体,该受体可引导T细胞攻击病变细胞。CAR T细胞疗法已产生显著影响,为部分既往无法治疗的晚期癌症患者带来了治愈可能。然而,该疗法仍存在局限性,包括严重毒性、工程化细胞存活期有限以及治疗耐药性。为解决这些局限性,研究人员开发了基因编码的小分子调控系统。这类系统可通过清除CAR T细胞或关闭其功能来阻断毒性反应;此外,还可通过直接靶向抗原或激活细胞毒性前药以扩大细胞杀伤能力,从而增强治疗效果。小分子调控剂包括蛋白酶抑制剂、蛋白二聚化剂、蛋白降解剂、双特异性衔接子以及条件激活型化疗药物。本文概述了基于小分子的调控策略,按功能对其进行分类,并详细阐述其分子机制;重点介绍了进入临床阶段的系统,同时强调了新兴应用领域及尚未满足的需求。
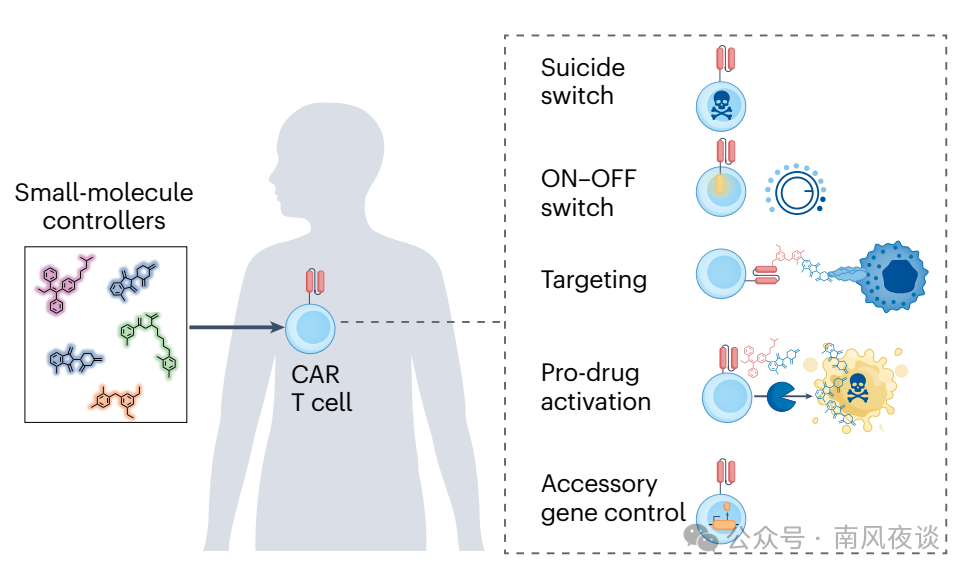

图1 | CAR T细胞简介、不足及小分子调控解决方案。a,嵌合抗原受体(CAR)T细胞通过CAR基因的病毒转导制备。CAR由单链可变片段(scFv)抗原结合结构域与T细胞信号结构域融合而成。患者接受CAR T细胞输注后,CAR与抗原结合,进而介导抗肿瘤功能。b,CAR T细胞疗法面临的挑战主要包括不良毒性反应和治疗效能有限。如连接线所示,多种小分子调控方法正用于解决这些挑战。CD3,分化簇3。
尽管CAR T细胞疗法具有优势和应用前景,但多项挑战限制了已获批疗法的疗效,并阻碍其向更多疾病适应证拓展。总体而言,这些障碍可分为安全性和治疗效能两大类。CAR T细胞疗法的毒性反应和副作用仍是亟待克服的主要障碍。免疫激活水平过高引发的全身性毒性包括:细胞因子释放综合征(一种可能导致多器官系统毒性的全身性炎症反应)、细胞因子风暴(由非特异性T细胞激活介导,导致γ-干扰素和肿瘤坏死因子释放)、神经毒性(包括CAR T相关脑病综合征)、噬血细胞性淋巴组织细胞增生症以及血细胞减少症。针对白细胞介素-6(IL-6)及其受体的药物(分别为西妥昔单抗和托珠单抗)常被用于阻断细胞因子释放综合征。然而,许多毒性反应可能致命,仍是重大关切问题。
另一毒性来源是CAR T细胞攻击表达靶抗原的正常细胞,这种情况被称为“脱靶-肿瘤外毒性”。例如,已获批的抗CD19 CAR T疗法不仅靶向肿瘤细胞,还会靶向表达CD19的正常B细胞,导致B细胞再生障碍(一种暂时性B细胞缺失),可通过输注混合免疫球蛋白缓解。不幸的是,其他由CAR T细胞介导的“脱靶-肿瘤外毒性”案例后果更为严重,已导致器官功能障碍甚至死亡。
此外,近期有研究关注CAR T细胞疗法相关的继发性恶性肿瘤,包括工程化细胞可能发生的恶性转化。在接受CAR T细胞治疗的患者中观察到继发性恶性肿瘤后,FDA已在获批疗法的说明书中添加黑框警告。然而,多项大型研究尚未发现CAR T细胞发生转化的证据;此外,最新数据表明,CAR T治疗可能不会增加继发性恶性肿瘤的发生率。值得注意的是,一种通过非病毒转座子载体递送的疗法已导致细胞恶性转化,这一结果凸显了对新型递送方式进行安全性评估的重要性。
获得足够治疗效能的挑战与毒性问题相互关联。影响效能的一个关键因素是病变部位CAR T细胞的数量,该数量受输注细胞剂量以及CAR T细胞在患者体内的增殖和存活情况影响。尽管传统上CAR T细胞在激活后会发生增殖,但长期激活、过度激活或缺乏适当辅助共信号激活的细胞,可能会发生程序性细胞死亡或细胞耗竭。持续性信号传导(CAR在无抗原情况下发生低水平聚集)是导致T细胞长期激活的主要原因之一,这会使受体产生基础活性,进而导致细胞早期耗竭。此外,病变细胞或辅助性免疫抑制细胞释放的免疫抑制信号,可直接抑制CAR T细胞的功能。然而,影响CAR T治疗效能的另一主要挑战是肿瘤组织内的抗原丢失或抗原异质性,这些问题会导致病变细胞无法被彻底清除。与小分子靶向药物的治疗失败类似,在CAR T细胞治疗后疾病复发的患者中,频繁观察到由靶基因突变和潜在抗原异质性引发的耐药机制。
CAR T细胞疗法独特的单次给药方式,进一步增加了医生应对CAR T细胞毒性的难度。传统药物可通过调整剂量和可预测的代谢过程实现精细的药代动力学调控,而CAR T细胞疗法作为“活药物”,会在体内扩增,且不同患者间细胞的存活时间存在差异。此外,患者接受CAR T细胞输注后,目前尚无获批方法能让医生在体内选择性调控工程化细胞的行为或清除它们。
因此,下一代CAR T细胞设计的核心方向之一,是开发能在输注后快速、可调控地控制CAR T细胞功能的技术。通常,这类系统由CAR T细胞中的一种或多种蛋白质构成,这些蛋白质可在临床医生提供的输入信号刺激下被激活或抑制。研究人员已开发出响应多种输入信号的“远程调控”系统,包括小分子、机械力、磁力、热和光。这些广泛的调控策略已有相关综述报道。
小分子调控系统因其诸多优势而备受关注。小分子是现代药理学的基石,具有可预测的动力学和生物分布特征。现有小分子种类丰富,可实现多种功能,包括病毒蛋白酶抑制剂、蛋白二聚化剂、蛋白水解靶向嵌合体(PROTACs)、双功能衔接子以及条件激活型化疗药物和激酶抑制剂。此外,许多已获FDA批准的小分子药物,可通过在系统设计中整合已知的相互作用蛋白结构域,重新用于CAR T细胞调控。与光、热或磁力等其他输入方式相比,小分子药物给药相对简便,无需复杂设备,且有望实现口服给药。小分子工具的广泛性还使其能够通过组合应用,实现对多种细胞行为的多输入和正交调控。图2展示了目前已用于调控的部分小分子,包括其结构、分子功能、靶蛋白及应用场景。补充表1列出了化合物名称及其PubChem化合物标识和化学文摘社登记号。已开发的小分子系统的目标主要分为四大类:CAR T细胞清除、CAR表达或组装调控、抗原靶向以及辅助基因功能调控。

图 2 | 用于调控 CAR T 细胞的小分子化学结构。本综述中讨论的部分小分子结构如图所示。小分子按功能分组,并提供以下补充信息:化合物名称(FDA 批准年份)、相互作用蛋白结构域,以及小分子嵌合抗原受体(CAR)系统的应用类型(由图例中定义的彩色星号标注)。对于因与其他显示分子(黑色文本)结构相似而未展示结构的分子,也提供了上述信息(灰色文本)。Bcl-XL,B 细胞淋巴瘤超大蛋白;Bim,Bcl-2 相互作用死亡介质;BRD4,含溴结构域蛋白 4;CRBN,cereblon 蛋白;DUPA,2-[3-(1,3 - 二羧丙基)脲基] 戊二酸;eDHFR,大肠杆菌二氢叶酸还原酶;ERT2,他莫昔芬响应型雌激素受体结构域;FITC,异硫氰酸荧光素;FKBP12,12 kDa FK506 结合与雷帕霉素结合蛋白;FOLR1,叶酸受体 1;FRB,FKBP - 雷帕霉素结合结构域;GAI,赤霉素不敏感蛋白;GID1,赤霉素不敏感矮化 1 蛋白;HCV,丙型肝炎病毒;HSV,单纯疱疹病毒;IKZF3,IKAROS 家族锌指蛋白 3;NS3,非结构蛋白 3;POM,泊马度胺;PSMA,前列腺特异性膜抗原;scFv,单链可变片段;sdAb,单域抗体;tBu,叔丁基;TetR,四环素阻遏蛋白;TetRB,四环素阻遏蛋白 B;TMP,甲氧苄啶。
理想的小分子调控系统具有一些共同特征:采用生理惰性的小分子诱导剂(具有良好的药代动力学和药效学特征)、可滴定、可逆,且其效应功能至少不低于标准CAR T细胞。CAR T细胞的小分子调控技术发展迅速,多种方法已进入临床评估阶段(包括 NCT03373097、NCT03016377 和 NCT02744287)。补充表2列出了本文发表时已注册的临床研究。
本文综述了当前及新兴的CAR T细胞小分子调控技术,按系统目标分类组织内容。在每个部分中,我们将介绍分子系统设计、基于小分子的调控机制以及每种方法的技术能力,同时讨论其临床转化的适用性(包括当前局限性);此外,还将探讨当前小分子系统未来的新兴应用领域,以及新型合成化学发展中亟待满足的关键需求。
Box 1 CAR T细胞疗法基础
嵌合抗原受体(CAR)T细胞疗法是一种免疫细胞疗法,通过基因修饰T细胞使其表达CAR,再将其输注到患者体内,以启动针对病变细胞的免疫攻击。CAR T细胞疗法备受关注,因其对晚期血液系统恶性肿瘤展现出强效抗肿瘤效应,而化疗、靶向药物等其他疗法对这类肿瘤往往无效。此外,该疗法利用人体自身清除病变细胞的天然机制,且具有“免疫记忆”潜力,可持续预防癌症复发——这一特性与人体在既往感染或接种疫苗后能更轻松清除感染的能力类似。
CAR是经工程化改造的细胞表面受体蛋白,可响应邻近靶细胞表面的抗原,调控免疫细胞(CAR T细胞疗法中为T细胞)的信号传导和效应功能。CAR具有嵌合性,由不同来源的结构域融合而成:最远端是胞外抗原结合结构域,负责识别靶细胞上的抗原;该结构域通过胞外间隔区(负责确定结合结构域与T细胞膜的距离,是信号传导的关键参数)与跨膜结构域(使受体定位于细胞膜)融合;胞内部分为细胞质信号结构域,负责激活T细胞受体(TCR)和共刺激信号通路。
大多数CAR设计采用抗体的单链可变片段(scFv)作为抗原靶向结构域,以TCR的“CD3ζ”细胞质结构域作为信号结构域;多数设计还包含共刺激细胞质信号结构域(如CD28或4-1BB),可为T细胞提供存活和扩增信号。与邻近细胞上的靶抗原结合后,T细胞表面会产生机械力并引发CAR聚集,这种聚集会触发T细胞受体和共刺激信号蛋白的激酶磷酸化级联反应,进而导致钙内流、靶细胞裂解、激活的CAR T细胞增殖,同时启动基因表达程序(包括表达γ-干扰素、肿瘤坏死因子等炎症细胞因子)。
T细胞受体需在主要组织相容性复合体(MHC)的背景下识别靶抗原,这要求人类白细胞抗原(HLA)配型——类似器官移植中供体与受体的配型。相比之下,CAR可直接结合细胞表面抗原,因此其功能不依赖HLA配型。
CAR T细胞疗法属于“过继性细胞疗法”,即CAR T细胞在体外制备后,过继转移回患者体内。目前CAR T细胞的制备策略仍在研发中,但已获批的疗法均遵循类似流程:通过白细胞分离术采集患者血液并分离T细胞;利用逆转录病毒或慢病毒转导将CAR基因导入患者T细胞;随后在体外扩增细胞(约100-1000倍),最后输注给患者。
目前已有7种CAR T细胞疗法获FDA批准,其中5种靶向CD19,用于治疗复发或难治性B细胞白血病和淋巴瘤;2种靶向BCMA,用于治疗复发或难治性多发性骨髓瘤。由于实体瘤占癌症病例的大多数,将CAR T细胞疗法应用于实体瘤是当前的研究热点。此外,多项临床试验显示,该疗法在严重自身免疫性疾病中也能产生显著的临床应答。
CAR T细胞的清除
首个应用于CAR T细胞的小分子调控系统是“自杀开关”,其目的是在给予药物后特异性清除CAR T细胞。该策略的设计初衷是作为一种安全开关,为CAR T细胞介导的危及生命的毒性提供紧急补救措施。理想的自杀开关应具备以下特征:快速(在检测到初始毒性后能立即停止进一步毒性作用)、特异性(仅清除CAR T细胞,不影响其他细胞)、可滴定(可部分终止效应,调控活性,使部分CAR T细胞得以保留)。总体而言,由于自杀开关会永久性清除CAR T细胞,可能导致抗肿瘤应答不可逆减弱,因此它更适合作为应对极端情况的补救机制。正因如此,自杀开关作为评估毒性谱未知的新型CAR T细胞策略的“故障保险”机制,备受关注。
最早开发的自杀开关是单纯疱疹病毒1型胸苷激酶(HSV-TK)系统。该系统由抗病毒药物更昔洛韦(一种鸟苷核苷类似物)调控。HSV-TK是更昔洛韦的靶基因,将其导入CAR T细胞后,可使CAR T细胞对更昔洛韦产生致死性敏感。全身性给予更昔洛韦后,HSV-TK将其磷酸化为单磷酸核苷,内源性细胞激酶进一步将其磷酸化为三磷酸核苷。这种代谢产物可竞争性抑制鸟苷掺入DNA,干扰DNA合成,最终导致细胞死亡。在人白血病和实体瘤异种移植小鼠模型中,表达HSV-TK系统的CAR T细胞显示出抗肿瘤效能;重要的是,实体瘤研究表明,更昔洛韦可有效清除CAR T细胞并降低其活性。尽管HSV-TK系统已在多项临床试验中开展研究,但由于未出现CAR T毒性,该系统未被激活,因此其激活效果尚未得到研究。HSV-TK系统存在一些局限性,例如需依赖细胞主动复制才能诱导死亡,导致细胞清除不完全,且细胞清除动力学较慢(需3–5天);此外,还观察到针对病毒来源HSV-TK基因的免疫原性,可能导致细胞在药物清除前就被机体清除。不过值得注意的是,在CAR T细胞试验中未观察到免疫原性。HSV-TK还被用于另一项临床应用:作为报告基因,通过正电子发射断层扫描(PET)对CAR T细胞进行成像。在该应用中,研究人员向胶质母细胞瘤患者施用了氟-18放射性标记的喷昔洛韦类似物——9-[4-[18F]氟-3-(羟甲基)丁基]鸟嘌呤([18F]FHBG),结果表明该系统安全有效,可用于CAR T细胞存活情况和定位的纵向追踪。
目前最成熟的CAR T细胞清除开关是诱导型半胱天冬酶9(iCasp9)系统。该系统利用二聚化化学诱导剂(CID)利米度昔(AP1903)或其类似物AP20187激活促凋亡酶半胱天冬酶9。利米度昔是一种可穿透细胞的他克莫司类似物,可特异性结合并使FK506结合蛋白(FKBP12)的F36V突变体发生同源二聚化。它与野生型FKBP12的结合力弱1000倍,因此不会抑制雷帕霉素靶蛋白(mTOR)激酶,具有生理正交性。在CAR T细胞中表达的iCasp9蛋白,其半胱天冬酶募集结构域被FKBP12F36V取代。加入CID后,iCasp9发生同源二聚化,触发凋亡信号级联反应。在人类临床试验中,iCasp9系统是所有CAR T细胞小分子调控系统中应用最广泛的(46项试验中有38项使用;补充表2)。该系统显示出显著效能:单次给予利米度昔或AP20187后,可在30分钟内快速清除细胞,清除率高达95%。它能够清除患者血液和中枢神经系统中的CAR T细胞,并缓解毒性反应。在其他多项研究中,iCasp9开关虽已导入但未被激活,这些研究证实iCasp9系统具有安全性,且不会对CAR T细胞的治疗效能产生负面影响。在另一项研究中,iCasp9系统还被证明具有可滴定性:低剂量利米度昔可缓解毒性,同时允许CAR T细胞在后续重新扩增并恢复抗肿瘤功能。由于iCasp9源自人类,因此基本无免疫原性。尽管该系统的清除效率足以缓解多种毒性,但对于严重的“脱靶-肿瘤外毒性”,其清除效果可能仍不足。
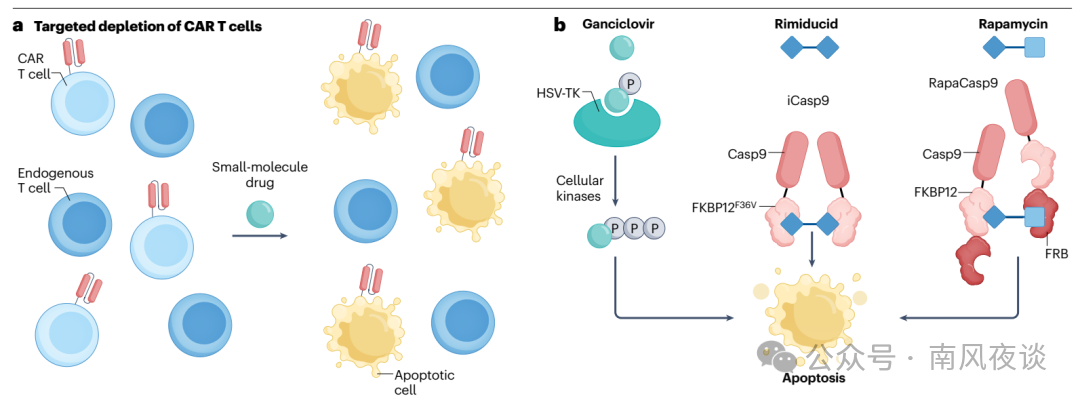
图3 | 清除CAR T细胞的小分子策略。a,靶向清除CAR T细胞的原理:CAR T细胞被工程化改造,导入可使其对小分子药物敏感的基因构建体,而非工程化的内源性细胞则不受影响。b,三种小分子介导的细胞清除系统:HSV-TK将更昔洛韦磷酸化,随后细胞激酶进一步将其磷酸化为强效DNA聚合酶抑制剂;利米度昔使iCasp9发生二聚化,雷帕霉素使RapaCasp9发生二聚化,进而启动半胱天冬酶级联反应,触发凋亡。CAR,嵌合抗原受体;Casp9,半胱天冬酶9;FKBP12,12 kDa FK506结合与雷帕霉素结合蛋白;FRB,FKBP-雷帕霉素结合结构域;HSV-TK,单纯疱疹病毒胸苷激酶;iCasp9,诱导型半胱天冬酶9;RapaCasp9,雷帕霉素激活型半胱天冬酶9。
iCasp9系统的一个局限性是,利米度昔和AP20187均未获FDA批准。“RapaCasp9”是另一种iCasp系统,它使用已获FDA批准的免疫抑制剂——大环天然产物雷帕霉素进行调控。在体外实验和临床前模型中,RapaCasp9显示出强效清除活性。雷帕霉素与其天然靶点mTOR的相互作用可能是一个潜在问题,但细胞清除所需的单次给药剂量通常具有良好耐受性,且其免疫抑制活性在缓解免疫毒性方面可能具有优势。因此,该系统具有较高的临床应用潜力。
CAR表达或组装的调控
缓解CAR相关毒性的另一种策略是利用小分子调控CAR蛋白的表达或组装。与自杀开关不同,该策略可保留治疗性细胞,并实现CAR T细胞激活的可逆性和时效性调控,同时还有可能改善T细胞的活性。抗原介导的T细胞长期激活或持续性受体信号传导,可能导致T细胞耗竭并最终发生凋亡;通过小分子调控使CAR信号“暂停”,已被证实是缓解这一问题、提升抗肿瘤效能的有效方法。
凭借这些优势,直接调控CAR的小分子系统已成为目前临床前研发的主要方向。研究人员开发了“开启”开关(小分子诱导CAR表达)和“关闭”开关(小分子清除或灭活CAR),其中许多系统可实现精细调控。然而,值得注意的是,若要维持长期活性,需频繁、重复给予小分子药物。如下所述,研究人员已开发出多种独特的CAR开关系统设计,这些系统虽有诸多共同特征,但其关键差异使其适用于特定场景。
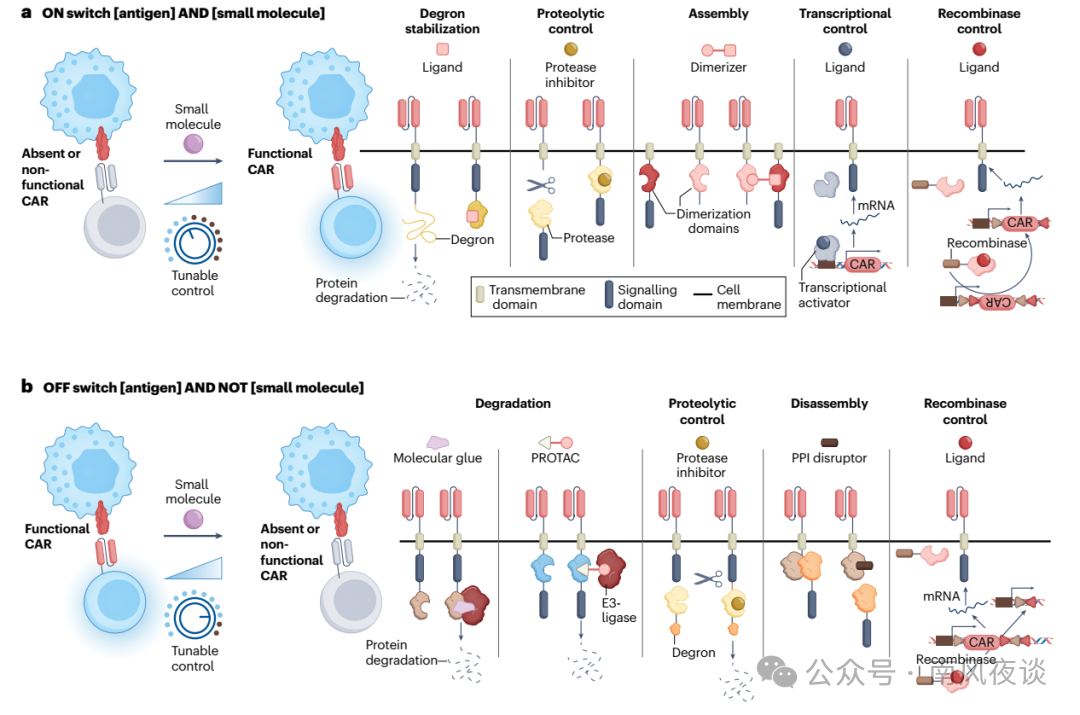
图 4 | CAR 表达及组装的小分子调控机制。