产品中心
技术交流

扫描二维码
精准递送与毒性平衡——ADC药物的分子机制、临床应用及其安全优化策略
文章来源公众号:药事纵横 作者:Magnolia
抗体药物偶联物(ADC)凭借单克隆抗体的靶向性与细胞毒性载荷的高效杀伤力,已成为肿瘤治疗领域的重要突破,并在多种实体瘤中展现出显著疗效。然而,其复杂的体内作用机制受药代动力学、组织分布及多重分子互作的精细调控,仍面临递送效率与毒性平衡等挑战。本文系统阐述ADC的体内作用机制,涵盖药代动力学特性、肿瘤组织渗透与胞内递送过程,分析实体瘤与血液系统肿瘤领域的临床应用现状。同时,从靶点相关性与载荷特性角度解析毒性谱特征,探讨降低非靶向毒性的设计策略。通过全面梳理ADC药物的结构优化、临床进展与安全挑战,为肿瘤精准治疗领域提供科学参考。

1.1系统循环与药代动力学调控
作为全身性治疗药物,ADC在静脉注射后需首先在循环系统中稳定传递。其药代动力学特性主要由抗体部分主导,具有类似单克隆抗体的长半衰期,但整体行为受到药物抗体比值(DAR)与连接子技术的深刻影响。过高的DAR会因亲脂性载荷的非特异性结合而加速清除,传统ADC因此常将DAR优化为4;而现代位点特异性偶联与亲水性连接子的发展,则提升了ADC的稳定性,使其在循环中更少发生提前解离,从而实现对ADC、裸抗体及游离载荷剂量的更精准控制。ADC依赖FcRn回收机制延长半衰期,同时其Fc段与Fcγ受体的相互作用也会影响免疫细胞摄取与清除速率。疗效的关键在于ADC能否高效外渗至肿瘤组织,这一过程受肿瘤血管通透性、血管化程度及ADC循环时间共同制约。进入肿瘤后,ADC通过高亲和力结合靶抗原实现滞留与富集,最终在胞内释放具有小分子代谢特征的游离载荷以发挥杀伤作用。
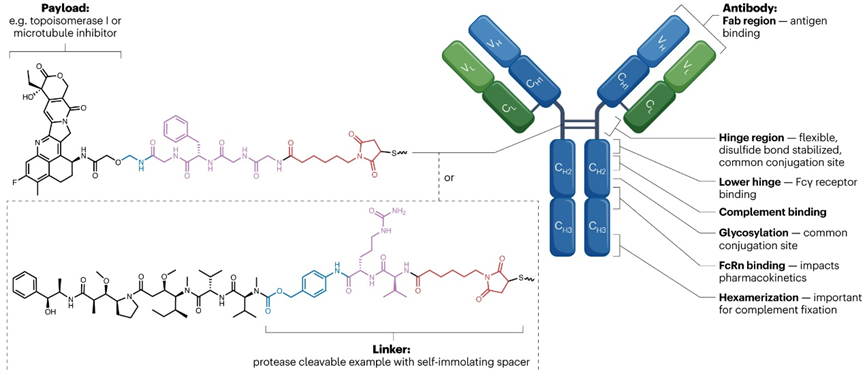
图1. ADC药物的分子结构
1.2肿瘤组织渗透与分布困境
ADC在实体瘤内的分布是其疗效的核心瓶颈,主要受“结合位点屏障”这一药代动力学因素限制——抗体与血管周围靶抗原的高速结合会迅速“锚定”ADC,阻碍其向肿瘤深部扩散。克服此障碍需要足够剂量的抗体以饱和近血管靶点,但ADC所携带的高毒性载荷又成为剂量限制因素。因此,采用高DAR或超高效载荷的设计虽可提升单药活性,却可能因需降低总给药剂量而削弱抗体在肿瘤内的整体覆盖与渗透深度。这揭示了ADC设计中的一个根本性权衡:必须在确保足量抗体以实现广泛肿瘤分布与维持足够载荷效力以拓宽治疗窗口之间取得平衡。这也解释了为何实体瘤ADC通常需要比血液肿瘤ADC更高的给药剂量,以应对更为严峻的瘤内递送挑战。
1.3胞内作用机制与疗效拓展
ADC的最终疗效依赖于从靶点结合到胞内载荷释放的一系列精密步骤:抗体以高亲和力结合靶抗原后,通过受体介导的内化进入细胞,内化效率取决于靶点与抗体的生物学特性。在内溶酶体途径中,连接子的化学性质(如可切割型、不可切割型或亲水性设计)精确调控载荷的释放时机与位置,需在循环稳定性与肿瘤内快速释放间取得平衡。释放的游离载荷进而作用于特定细胞内靶点。此外,ADC的疗效还受到载荷膜通透性与Fc段介导的免疫效应的综合影响。具有膜通透性的载荷可产生“旁观者效应”,扩散至邻近抗原阴性细胞,这对治疗靶点异质性肿瘤尤为重要;而Fc段与Fcγ受体结合不仅能促进免疫细胞摄取ADC,还可触发ADCC、ADCP等效应,增强抗肿瘤免疫。因此,成功的ADC设计必须在载荷效力、DAR、内化效率、旁观者杀伤潜力及免疫激活功能之间寻求整体优化,以实现安全、高效的肿瘤杀伤。
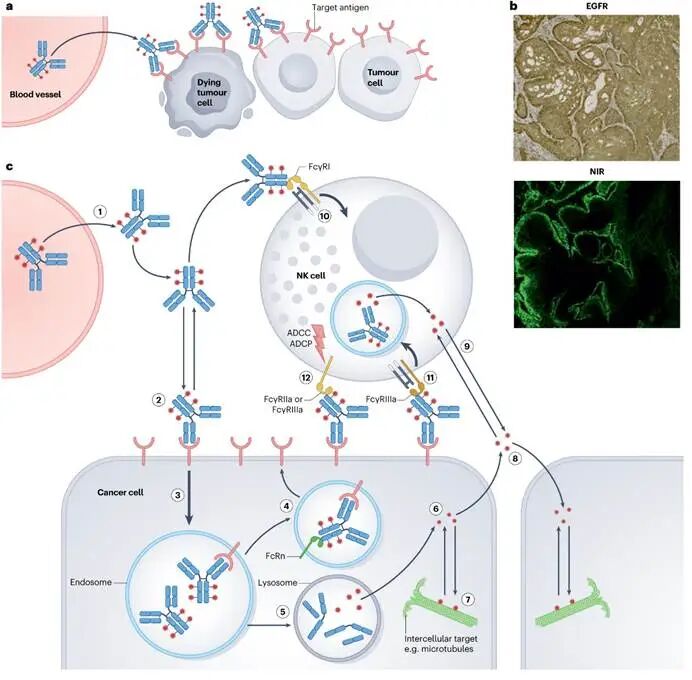
图2. 通过组织与细胞层面的药代动力学图示
2.1实体瘤中批准的ADC药物
在实体瘤领域,国内外已有10款ADC药物获批(中国获批的包括恩美曲妥珠单抗、维恩妥尤单抗、戈沙妥珠单抗、索米妥昔单抗、德达博妥单抗、维迪西妥单抗、芦康沙妥珠单抗共计7种),涵盖HER2、Nectin-4、TROP2、FRα、MET等多个靶点,展现出精准治疗肿瘤的突破性进展。其中,恩美曲妥珠单抗是首个获批的ADC药物,于2013年获得美国食品药品监管管理局(FDA)批准,用于HER2阳性转移性乳腺癌,其载体为DM1(美登素衍生物),通过非可裂解连接子与抗体结合,剂量为3.6 mg/kg,每3周给药一次(Q3W),成为HER2阳性乳腺癌治疗的重要选择。随后,维迪妥昔单抗于2021年获中国国家药品监督管理局(NMPA)批准,针对HER2阳性胃癌,采用MMAE(单甲基澳瑞他汀E)作为载体,连接子为蛋白酶可裂解的二硫键,剂量2 mg/kg,Q3W给药,填补了胃癌靶向治疗的空白。Enfortumab deruxtecan于2019年获FDA获批,针对尿路上皮癌,靶向Nectin-4,载体为DXd(拓扑异构酶I抑制剂),DAR值高达8,剂量5.4/6.4 mg/kg,Q3W给药,显著延长了患者生存期。
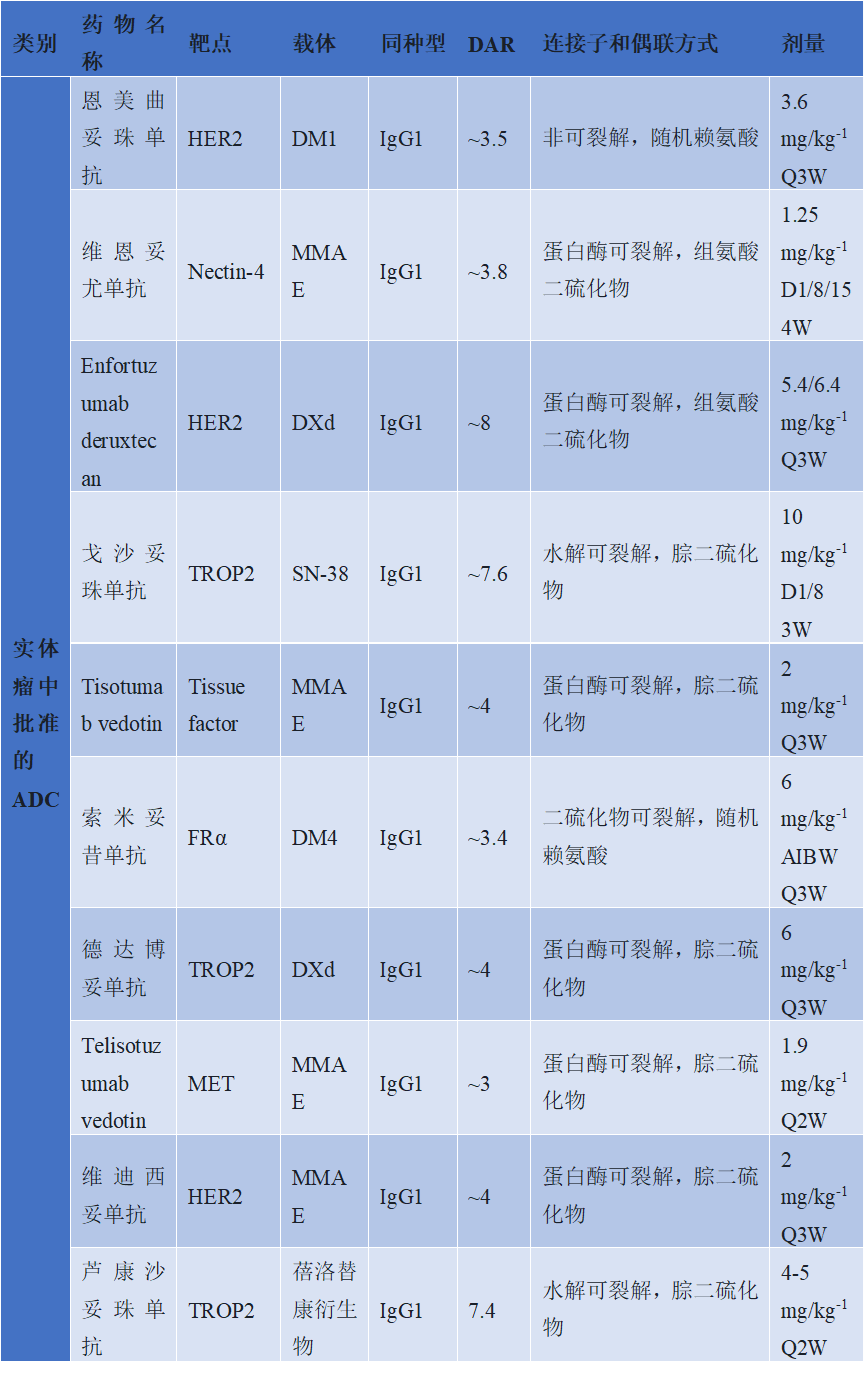
图3. 实体瘤中批准的ADC药物
2.2血液系统恶性肿瘤中批准的ADC药物
在血液瘤领域,已有6款ADC药物获批(中国获批的包括维布妥昔单抗、奥加伊妥珠单抗、维泊妥珠单抗、替朗妥昔单抗共计4种),主要针对CD3、CD20、CD22、CD79b等B细胞表面抗原,为淋巴瘤和白血病治疗提供了新的选择。其中,Gemtuzumab ozogamicin是首个获批的血液瘤ADC药物,于2000年获FDA批准上市,靶向CD33,载体为Calicheamicin(卡奇霉素),DAR值2-3,连接子为二硫键,剂量0.081 mg/kg,每4-7天给药一次(Q1/4/7),用于急性髓系白血病(AML),是AML治疗的重要药物。
维布妥昔单抗于2011年获FDA批准,并于2020年5月获NMPA批准上市,随后在2021年4月,其适应症扩展至CD30阳性的既往接受过系统性治疗的原发性皮肤间变性大细胞淋巴瘤(PCALCL)或蕈样真菌病(MF)成人患者。维布妥昔单抗靶向CD30,载体为MMAE,连接子为腙二硫化物,剂量1.8 mg/kg,Q3W给药,用于霍奇金淋巴瘤和间变性大细胞淋巴瘤,显著提高了患者的缓解率和生存期。Belantamab mafodotin于2020年获FDA批准上市,靶向BCMA,载体为MMAF(微管抑制剂),连接子为非可裂解的随机赖氨酸,剂量2.5 mg/kg,Q3W给药,用于多发性骨髓瘤,成为BCMA阳性多发性骨髓瘤的治疗新选择。替朗妥昔单抗(Tisagenlecleucel)于2017年获批,靶向CD19,载体为PBD(吡咯并苯并二氮杂卓二聚体),DAR值2.3,连接子为腙二硫化物,剂量0.15-0.075 mg/kg,Q3W给药,用于B细胞急性淋巴细胞白血病(B-ALL)和弥漫性大B细胞淋巴瘤(DLBCL),是CAR-T疗法的替代选择,为血液瘤治疗提供了新的思路。
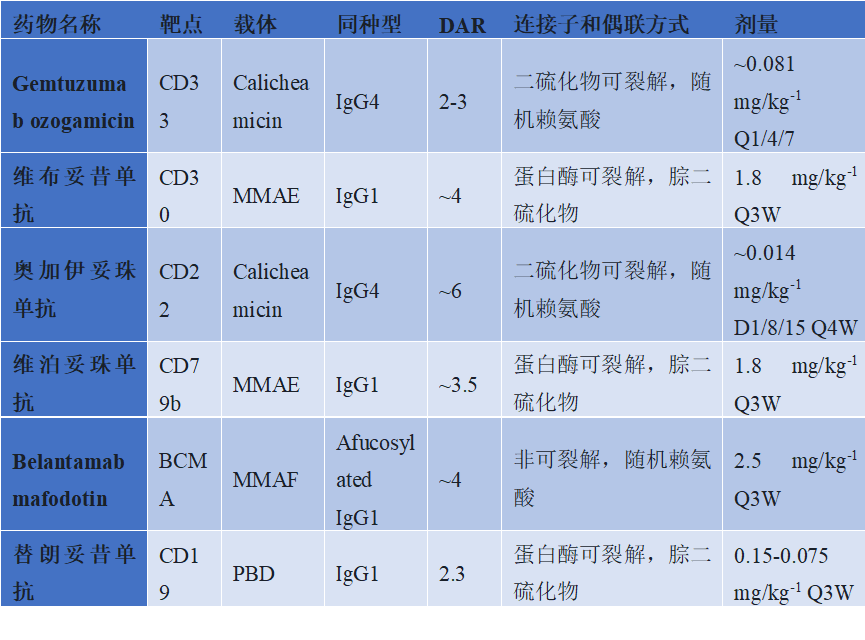
图4. 血液系统恶性肿瘤中批准的ADC药物
3.1 靶点相关性与载荷主导的毒性谱
ADC的系统性毒性主要源于健康组织对药物的非靶向摄取。尽管存在因靶点在正常组织中表达而引起的靶向毒性(如心脏或唾液腺损伤),但临床证据表明,ADC的剂量限制性毒性与整体毒性谱主要由其搭载的细胞毒性载荷的内在特性决定。例如,搭载微管抑制剂MMAE的ADC普遍导致外周神经病变和骨髓抑制,而搭载PBD二聚体的ADC则常引起肝损伤和血管渗漏综合征,这与所靶向的肿瘤抗原类型关联不大。这提示,载荷性质是决定ADC临床毒性特征的核心因素。
3.2 非靶向摄取的核心机制:理化性质与受体介导途径
载荷在健康组织中的非靶向释放,主要驱动机制是完整ADC分子被正常细胞非特异性内吞。这一过程受两大因素驱动:一是ADC的理化性质,如过高的药物抗体比(DAR)带来的疏水性或净正电荷,会增强其与细胞膜的非特异性结合,导致清除加快和耐受性降低;二是特异性受体相互作用,其中Fc段与Fcγ受体的结合尤为关键,例如肺泡巨噬细胞摄取ADC可能导致间质性肺病,而巨噬细胞对巨核细胞的FcγRIIa介导内吞则与血小板减少症相关。此外,肝细胞上的甘露糖受体摄取也是肝毒性的常见原因。因此,通过优化DAR、调节电荷或改造Fc段以减少非预期受体结合,是降低此类毒性的关键设计方向。
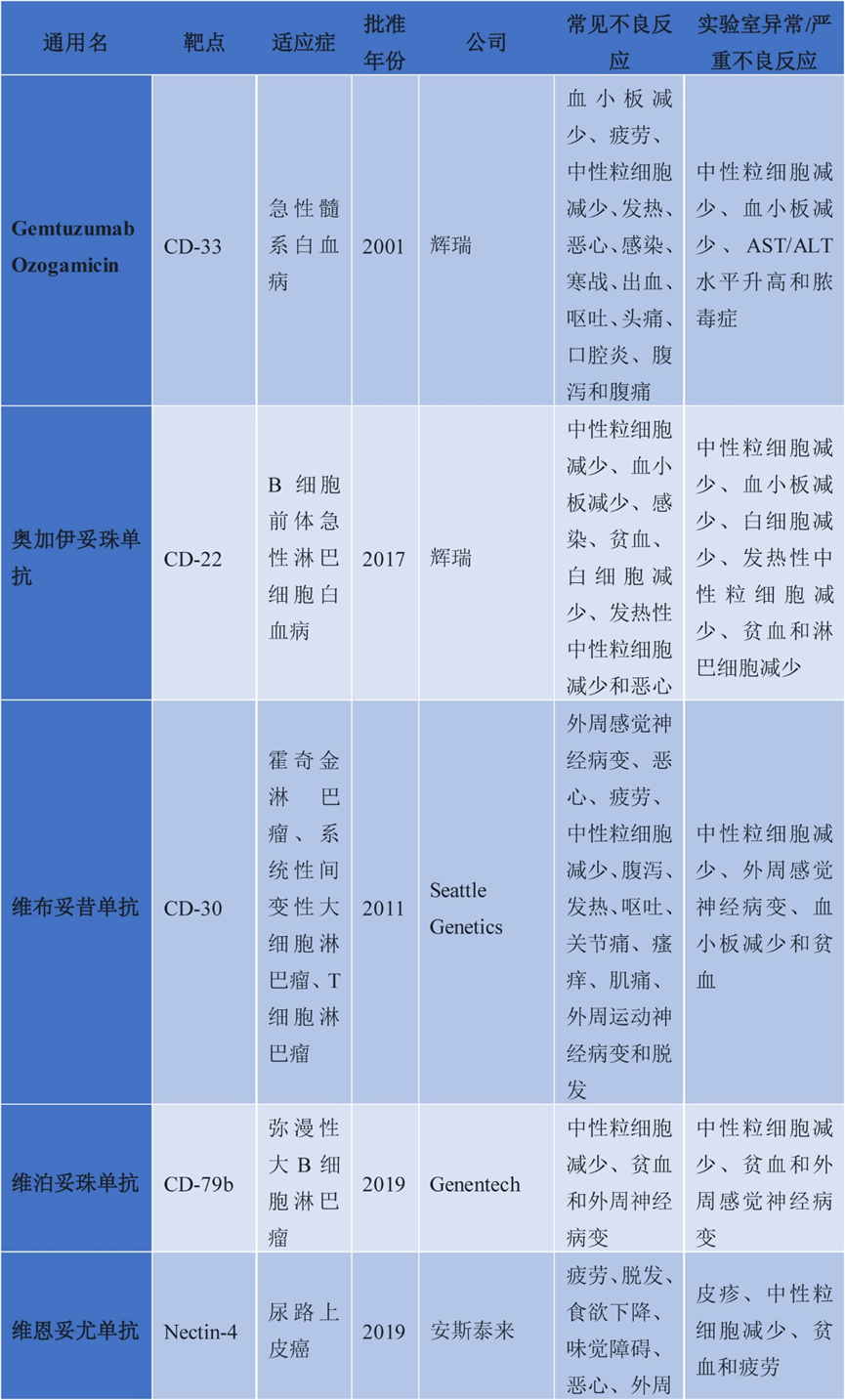
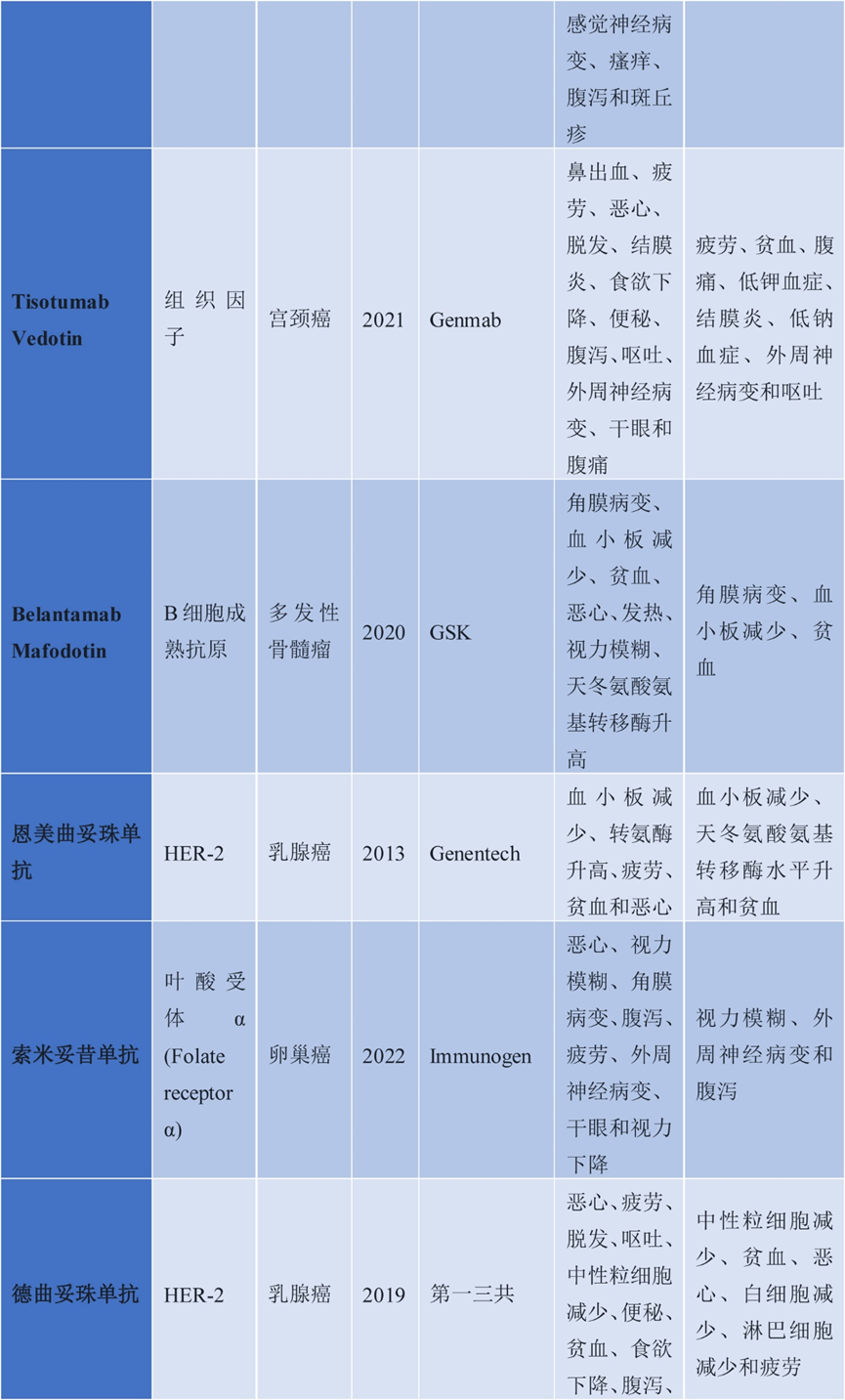
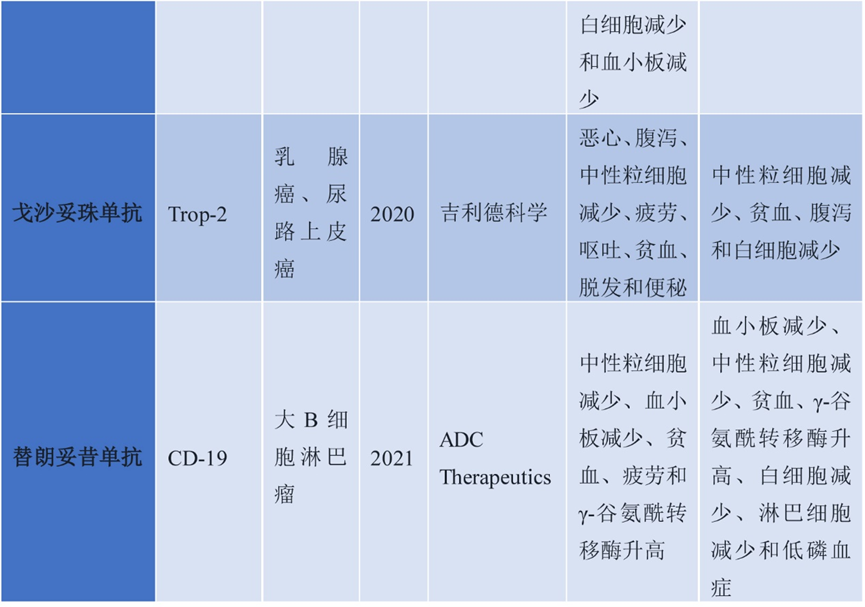
图5. ADC药物的毒性
3.3 连接子稳定性、旁观者效应与毒性平衡
连接子稳定性与载荷特性深刻影响着ADC的治疗窗与毒性。可切割连接子虽能通过释放亲脂性载荷产生“旁观者效应”以杀灭异质性肿瘤,但其在循环中的提前裂解释放游离载荷,会加剧全身毒性。为此,开发载荷中和抗体等策略正受到关注。同时,尽管位点特异性偶联等技术提高了ADC的均一性与稳定性,可能拓宽治疗窗,但也可能因改变药代动力学而引发新的毒性(如眼部毒性),体现了疗效与安全性之间的复杂权衡。因此,开发毒性更低的新型载荷(如蛋白降解剂),并精准平衡肿瘤内有效载荷浓度与全身可耐受剂量,是降低ADC毒性的根本策略。
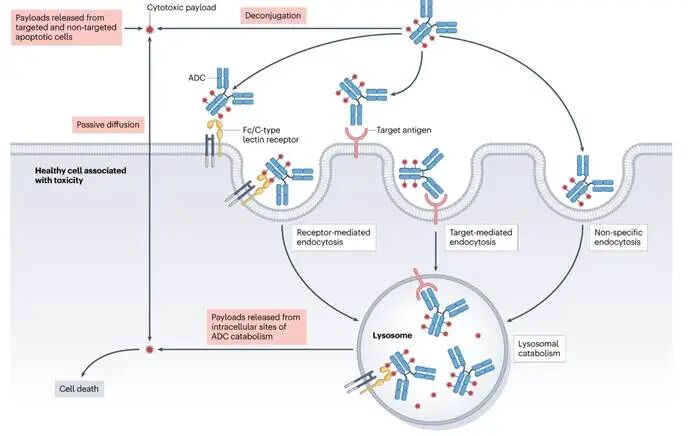
图6. ADC药物的毒性分子机制示意图
综上所述,ADC药物已形成相对成熟的技术体系,在实体瘤与血液系统恶性肿瘤中展现出明确的治疗价值。其疗效主要取决于药代动力学特性、肿瘤组织渗透效率及胞内递送过程的精细协同,而毒性谱特征则由载荷性质、连接子稳定性及非靶向摄取机制共同决定。未来ADC发展需在优化DAR与连接子设计的基础上,开发新型低毒载荷并改善Fc段工程,以精准平衡肿瘤内有效浓度与全身安全性,进一步拓宽治疗窗口,实现更安全高效的肿瘤精准治疗。