产品中心
技术交流

扫描二维码
肿瘤特异性激活的遮蔽型CART
本文来源于微信公众: Of studies 作者: Of studies
嵌合抗原受体工程化T细胞(CAR-T)治疗是一种强有力的癌症免疫疗法。CAR-T细胞可被重新定向,特异性识别肿瘤相关抗原(TAA),并诱导高水平的抗肿瘤活性。然而,由于TAA在健康组织中低水平表达,它们也可能引发“靶向肿瘤但脱靶正常组织on target off tumor”的毒性。这些不良反应已引起重大安全问题,并限制了这一原本前景广阔的治疗方式的临床应用,遮蔽肽可能是免疫治疗的下一个风口。
学习一篇很早的2017年发表在Molecular Therapy的文章,研究者给CART戴上面具,设计了一种针对表皮生长因子受体(EGFR)的遮蔽型CAR(masked CAR),其由一段遮蔽肽(可阻断抗原结合位点)和一个蛋白酶敏感连接肽组成。肿瘤微环境中常见的蛋白酶可切割该连接肽,使遮蔽肽脱落,从而让CAR-T细胞仅在肿瘤部位识别靶抗原。体外实验显示,在没有蛋白酶的情况下,masked CAR的抗原结合能力和抗原特异性激活显著降低;而在加入特定蛋白酶后,其结合与活性恢复至正常水平。遮蔽型CAR-T细胞在体内的抗肿瘤效果与未遮蔽CAR相当。
主要结果
1、EGFR CART的设计

编码masked遮蔽肽序列:QGQSGQCISPRGCPDGPYVMY(源自Cetuximab probody 的抗原结合位点封闭肽);
蛋白酶敏感 linker(可切)序列:GSSGGSGGSGGSG-LSGRSDNH-GSSGT;
蛋白酶底物序列LSGRSDNH是uPA/matriptase/legumain(在肿瘤微环境显著上调的蛋白水解酶)的底物核心,两侧用 GS-rich 柔性链隔开。
非切割对照 linker(NSUB)序列:GSSGGSGGSGGSG-GGSGGGSG-GSSGT;
把酶底物序列 -LSGRSDNH- 换成了同长度、不可切的 GS 富集序列(8个氨基酸):
2、CAR的表达和遮蔽情况
从人外周血单个核细胞(PBMCs)中分离出的细胞经活化后,用不遮蔽、遮蔽和 NSUB 抗 EGFR 嵌合抗原受体(CAR)的逆转录病毒载体进行转导,并在体外扩增10天。PL流式测 CAR 表面表达,rhEGFR-Fc 流式测结合能力
三组 CAR 表达率均 ≈ 30–35 %(无差异);
结合率:Unmasked 35 % → Masked 3 % → NSUB 0.4 %;masked把结合力降到背景,说明遮蔽有效。

(A)用生物素化的蛋白 L 对三组 CAR-T 细胞进行染色,然后用 APC 标记的链霉亲和素进行检测,以检测细胞表面的 CAR 表达情况。
(B)将 CAR-T 细胞与重组人 EGFR-Fc 蛋白孵育,然后用 PE 标记的山羊抗人 Fc 抗体进行染色,以评估 CAR 与其靶抗原人 EGFR 的结合能力。
3、蛋白酶处理后不同嵌合抗原受体(CAR)与靶抗原 EGFR 的结合情况
不遮蔽、遮蔽和 NSUB 抗 EGFR CAR-T 细胞经不同浓度(0 nM、100 nM 和 400 nM)尿激酶型纤溶酶原激活剂(uPA)处理后,用重组人 EGFR-Fc(rhEGFR-Fc)和山羊抗人 Fc 抗体进行染色,以评估蛋白酶处理对 CAR 与抗原结合的影响。

0 nM 时结合 6 %;100 nM 结合23 %;400 nM 结合 29 %(接近 Unmasked),结合恢复呈uPA剂量依赖, linker 被切。
4、不同靶细胞刺激下的各种 CAR-T 细胞的细胞内因子染色
在体外激活和扩增 10 天后,未修饰型、修饰型和 NSUB 型 CAR-T 细胞分别与 K562、K562-EGFR、MDA-MB-231 或 NCI-H292 细胞共培养 6 小时。未受刺激的 CAR-T 细胞用作阴性对照,而受抗 CD3/CD28 抗体刺激的 CAR-T 细胞用作阳性对照,通过细胞内染色测量干扰素γ(IFN-γ)的产生量。
K562-EGFR稳定株高表达EGFR,但几乎不分泌 uPA(尿激酶型纤溶酶原激活物-是一种丝氨酸蛋白酶),MDA-MB-231和NCI-H292高分泌uPA。
A图为一个donor的代表性流式结果,B为3个donor定量数据。

Unmasked 对任何 EGFR⁺ 细胞均 15–20 % IFN-γ⁺;
Masked 对 K562-EGFR (无蛋白酶环境)仅 0.9 %(关闭状态);对 MDA231/H292 (分泌蛋白酶环境)升至 16–17 %(遮蔽型CART的linker裂解,打开EGFR结合点);
NSUB 始终 < 7 %;
证明蛋白酶存在才能摘掉面具,“解锁”T 细胞激活。
5、不同 CAR-T 细胞对不同靶细胞系的体外细胞毒性作用
CFSE 标记靶细胞 → 与 CAR-T 按 1:1–10:1 共孵 → 7-AAD 流式算存活率

Unmasked 杀 K562-EGFR、231、H292 均高效;
Masked 几乎不杀 K562-EGFR(E:T=10 时仅 20 % 杀伤),但对 231 和 H292 杀伤可恢复至 Unmasked 水平;
NSUB 杀伤始终低下;
体内外功能一致:肿瘤蛋白酶=杀伤开关。
(A)CAR-T 细胞以 1:1、3:1 或 10:1 的效应细胞与靶细胞比例与 K562-EGFR 细胞共培养 4 小时,然后测量对 K562-EGFR 细胞的细胞毒性。
(B)CAR-T 细胞以 1:1、3:1 或 10:1 的效应细胞与靶细胞比例与 NCI-H292 细胞共培养 18 小时,并测量细胞毒性。
(C)CAR-T 细胞以 1:1、2.5:1、5:1 或 10:1 的效应细胞与靶细胞比例与 MDA-MB-231 细胞共培养 18 小时,并测量细胞毒性。
6、CAR-T 细胞在人类肺癌异种移植模型中的抗肿瘤效果
NSG 鼠右胁皮下 NCI-H292 肺癌模型,12 d 后瘤≈120 mm³ → 随机 4 组(n=8),D13、D26 尾静脉输注 4×10⁶ CAR-T
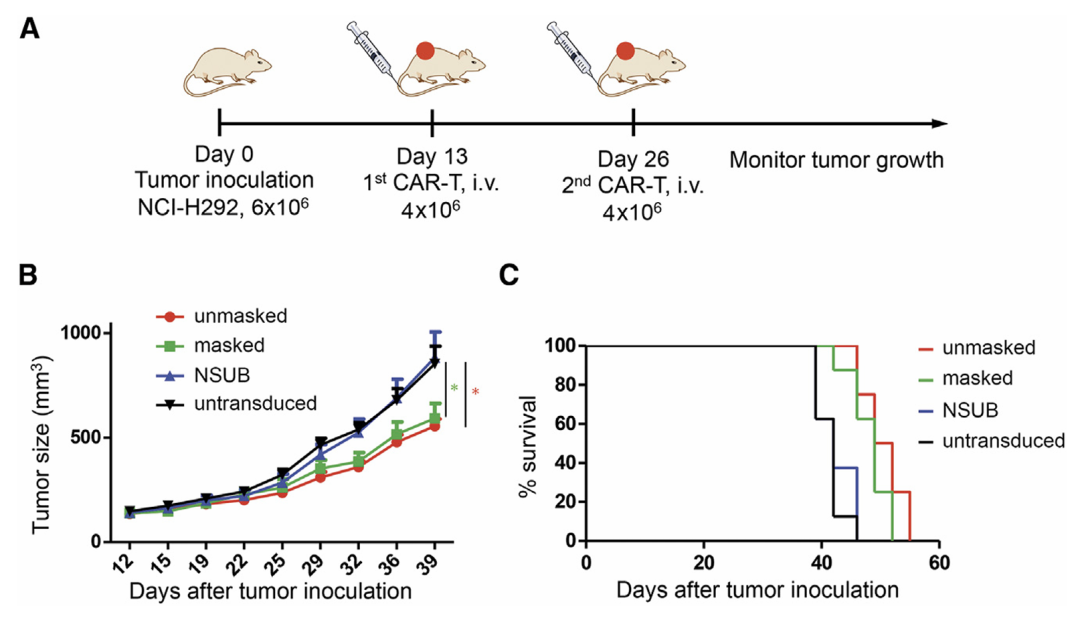
Unmasked 与 Masked 均显著受抑(p<0.05),两组曲线重叠;NSUB 与对照无差异;Unmasked 中位 50.5 d,Masked 49 d;对照/NSUB 42 d(p<0.01)
遮蔽未削弱体内抗肿瘤效果,且安全性提升(无体重下降、皮肤/肠道毒性观察)。
(A)体内 CAR-T 治疗方案的示意图。在第 0 天,将 NCI-H292 细胞注射到 NSG 小鼠的右侧腹侧。将小鼠随机分为四组(每组 8 只),分别在第 13 天和第 26 天接受4E6 CAR-T 细胞的治疗;未转导的 T 细胞作为对照组。每周用卡尺测量肿瘤大小两次。 (B)各组的肿瘤生长曲线。 (C)使用 Kaplan-Meier 法计算小鼠生存曲线。
附:
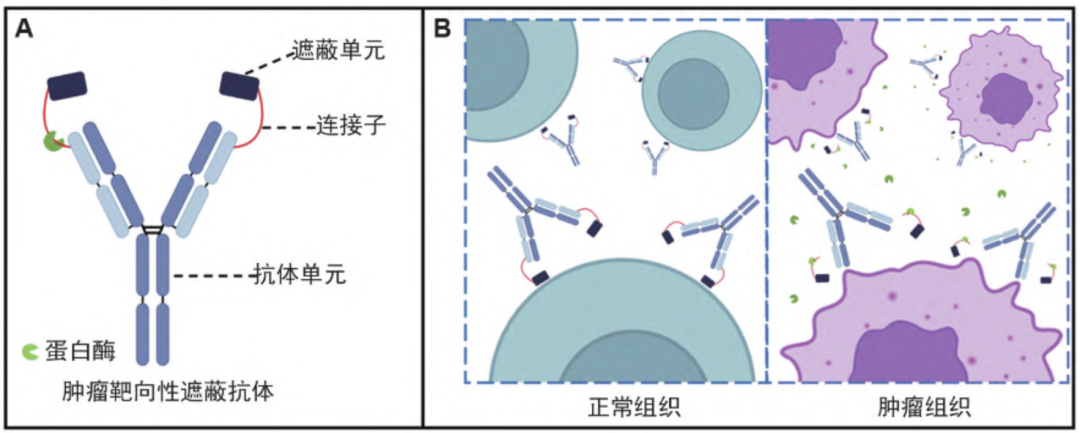
Cetuximab probody 是2013 年AbbVie在Science Translational Medicine报道的“前体抗体”(pro-antibody)版本 cetuximab,可理解为给原抗体加了一个可脱卸的“安全帽”,让它在健康组织保持沉默,到达肿瘤后才被激活。
结构:重链 N 端额外融合了一段 12-14 aa 的“遮蔽肽”(masking peptide),遮蔽肽与重链之间插入一条肿瘤相关蛋白酶(uPA、matriptase 等)可切割的 linker。
作用机制:循环中:遮蔽肽折叠回来堵住 Fab 的 CDR 区,EGFR 结合力降低 50–500 倍,Fc 功能也被抑制,几乎不与正常组织 EGFR 结合。
肿瘤微环境:高浓度 uPA/matriptase 把 linker 切断 → 遮蔽肽脱落 → 抗体“解锁”,结合力恢复至母本 cetuximab (西妥昔单抗靶向EGFR)水平 → 照常阻断 EGFR 信号并介导 ADCC/CDC。
小结
masked CAR在正常组织静默,到肿瘤被蛋白酶掀开面具后才完全恢复结合-激活-杀伤活性,实现同等疗效同时把正常组织on-target off-tumor风险压到最低。这项早期研究证实了改善传统CAR安全性的可行性,并可能为今后设计靶向广泛表达TAA的CAR分子提供新思路。