间充质干细胞的成脂诱导分化实操,我最挂心的事儿解决了
在大多数干细胞实验研究中,诱导分化成骨细胞、脂肪细胞、软骨细胞已经成为鉴定其分化潜能的金标准。本期将介绍成脂诱导分化操作。
▶成脂诱导分化
脂肪组织由脂肪细胞组成,对保持能量和代谢平衡非常重要。脂肪组织有两种,一种为白色脂肪组织(WAT),主要分布在皮下和内脏,内脏白色脂肪与肥胖、病理验证和胰岛素抵抗相关,皮下白色脂肪则可提高葡萄糖耐受性;另一种为棕色脂肪组织(BAT),主要呈离散状分布在脊椎旁、锁骨和肾上腺,功能是产热。这两种脂肪组织有相同的分化特征,都是由间充质干细胞分化而来。
◆ 体外诱导成脂分化的鉴定
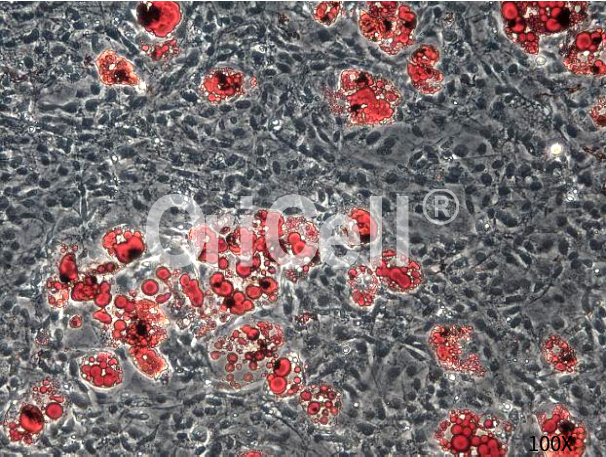
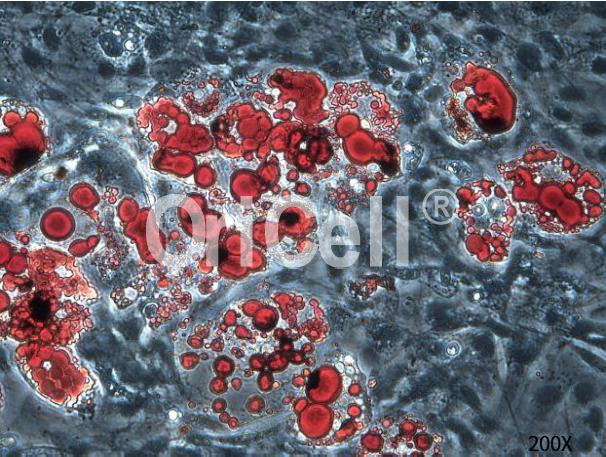
✔ 检测成脂诱导后细胞的胞浆中的油滴(脂肪滴)。脂肪滴经油红O染色后在显微镜下呈现显著的红色,未分化细胞则无明显颜色。通过统计各样品中成脂分化细胞的百分比来对成脂分化强弱加以表征对比。
✔ MSC成脂分化后有明显的成脂特征性基因表达,如LPL、PPARγ等。可使用RT-PCR通过对相关基因表达量的测量,对比不同实验组别的成脂分化差异。
OriCell®人脂肪间充质干细胞成脂诱导分化油红O染色效果


OriCell®小鼠脂肪间充质干细胞成脂诱导分化油红O染色效果


OriCell®小鼠骨髓间充质干细胞成脂诱导分化油红O染色效果
▶实验材料及流程
01 所需材料
OriCell®间充质干细胞成脂诱导分化试剂盒
✔ OriCell®间充质干细胞成脂诱导分化试剂盒(套装内A、B液成分含基础培养基、优级胎牛血清、成脂诱导添加物;油红O染色液、明胶)
✔ OriCell®Phosphate-Buffered Saline (1×PBS) (货号:PBS-10001)
02 诱导分化操作步骤
(注:A、B液配置方法详见产品说明书)
① 加1mL 0.1%明胶到六孔板中,摇匀,使其能均匀覆盖各孔底面。
② 将铺有0.1%明胶的六孔板放置在超净台或CO2培养箱至少30min。
③ 30min后吸去明胶即可用于接种细胞,或等待六孔板晾干再接种。
④ 将待诱导的间充质干细胞按照2×104cells/cm2的细胞密度接种于六孔板中,每孔加入2mL普通完全培养基。
⑤ 细胞置于37℃、5%CO2、饱和湿度的CO2培养箱中培养。
⑥ 当细胞汇合度达到100%时,小心地将孔内完全培养基吸走,向六孔板中加入2mL OriCell® 间充质干细胞成脂诱导分化培养基A液。
⑦ 诱导3天后,吸去六孔板中的A液,加入2mL OriCell®间充质干细胞成脂诱导分化培养基B液。
⑧ 维持1天后,吸去B液,换回A液进行诱导。
⑨ A液和B液交替使用,期间需每天观察细胞状态。若在A液诱导过程中出现细胞收缩、死亡的情况,请及时更换为B液,直至细胞状态恢复。
⑩ 重复诱导和维持过程,直到出现足量、大小适宜的脂滴,即可准备染色。
03 油红O染色
① 成脂诱导分化结束后,吸去六孔板中的成脂诱导分化完全培养基,用1×PBS轻柔洗涤2~3次。
② 每孔加入2mL 4%多聚甲醛溶液(或10%福尔马林),室温,固定30min。
③ 按油红O贮存液:蒸馏水=3:2比例,配制为工作液。混匀后250×g离心4min,使用上清。
④ 吸去固定液,用1×PBS轻柔洗涤2~3次,确保将固定液清洗彻底。
⑤ 每孔加入2 mL油红O染料工作液,室温染色 30min。
⑥ 吸去油红O染色液,用1×PBS轻柔洗涤2~3 次,充分洗去染色液。
⑦ 每孔加入2mL 1×PBS,将培养板置于显微镜下观察成脂染色效果。
⑧ 染色后的六孔板用封口膜封装后,置于4℃保存,但不要超过1周。脂滴会相互融合,无法保持染色时的状态。
▶注意事项
✔ 本操作规程以六孔板为例,请根据实际情况选用合适的培养容器。
✔ 为减少诱导过程细胞漂起、不贴壁,建议使用明胶包被培养容器。
✔ 诱导培养基在使用前均需预热至 37℃。
✔ A液刺激脂滴形成;B液维持已形成的脂滴,并促进脂滴增大。
✔ 通常情况下,按照“A液3天,B液1天”的使用方式即可顺利诱导细胞成脂。
✔ 各类、各批次细胞在诱导过程中可能出现多种情况,请灵活调整A、B液的使用比例。
✔ 为防止脂滴脱落,所有操作尽可能轻缓。