产品中心
技术交流

扫描二维码
逐典分享 | 免疫检查点及阻断策略
近年来免疫肿瘤学研究方面的突破性进展带来了肿瘤攻击形式上的重大变革。免疫肿瘤学的进展使以往实践表明手术、放疗、化疗和靶向治疗疗效欠佳的肿瘤发生持久性的消退。目前,免疫肿瘤学研究中最热门的两个领域当属免疫检查点抑制剂和嵌合抗原受体(CAR) T细胞疗法。这两种模型大相径庭,各有独特的优势。
免疫检查点是一类免疫抑制性的分子,可以调节免疫反应,从而避免正常组织的损伤和破坏,在肿瘤的发生、发展过程中,免疫检查点成为免疫耐受的主要原因之一。免疫检查点疗法就是通过共抑制或共刺激信号等一系列途径以调节T细胞活性来杀伤肿瘤细胞的治疗方法。目前,人们仅对一小部分免疫检查点进行了鉴定和开发,以期用于治疗。
免疫检查点作为一些关键的细胞通路,可维持正常的免疫反应,当免疫系统激活时可保护组织免于损伤。肿瘤细胞可下调免疫检查点,以此作为免疫抵抗的一种机制。了解自然杀伤(NK)细胞和T细胞中的免疫检查点是当前研究的主要焦点,因为上述细胞可同时调控肿瘤周围的适应性免疫和固有免疫反应(如下图)。
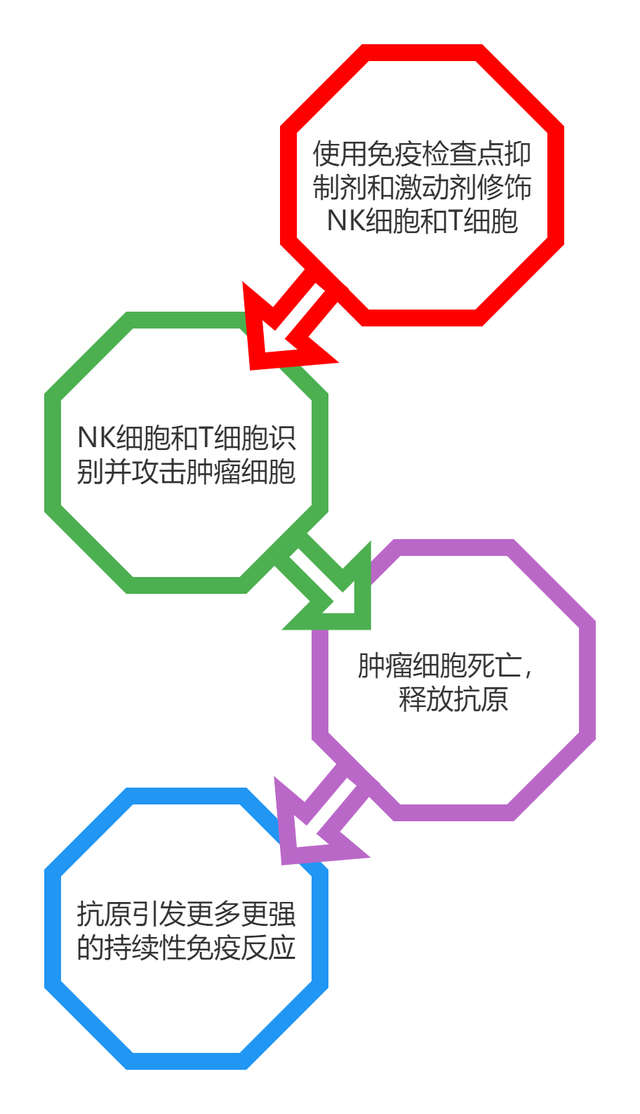
近年来,免疫检查点抑制剂方面取得了巨大的进步,这些抑制剂可引导和调控T淋巴细胞的增殖和功能,干扰某些信号通路,激活或抑制细胞事件,从而直接或间接调节免疫细胞的活性。
常见的免疫检查点
天然免疫细胞上的免疫检查点
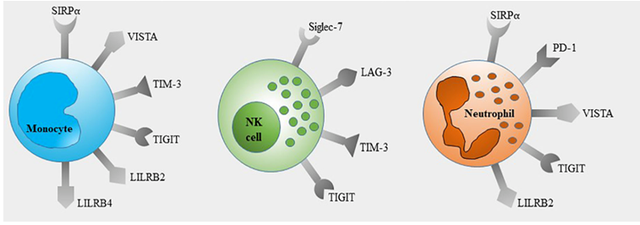
天然免疫细胞上的免疫检查点
SIRPα
SIRP的中文全称是信号调节蛋白(Signal regulatory proteins,又称CD172a, PTPNS1, MFR, p84, BIT, SHPS-1),SIRPα是SIRP家族中的一个典型抑制性免疫受体,其与配体CD47结合从而阻止巨噬细胞吞噬健康细胞,癌细胞也可以借此逃过免疫系统监视。SIRPα在人体内并非广泛表达,主要表达于髓系细胞表面(单核细胞、巨噬细胞、粒细胞以及髓系DC细胞等),也在神经系统的神经元细胞中表达。
VISTA
VISTA(T细胞活化的V结构域Ig抑制因子,又称VSIR、Gi24、Dies-1、PD-1H、B7-H5、C10或者f54、SISP1和DD1α),于2011年首次被描述为Ig超家族中具有抑制T细胞活化作用的新成员。VISTA是免疫稳态和抗肿瘤免疫的重要调节剂。在免疫细胞中,VISTA主要由髓系细胞(中性粒细胞、单核细胞、巨噬细胞和树突状细胞)表达,Naive T细胞和CD4+T细胞低表达VISTA,CD8+T细胞、Foxp3+Treg和CD56dimNK细胞上VISTA表达量更低,而CD56brightNK细胞和B细胞大多表达VISTA阴性。
TIM-3
TIM-3(又称HAVCR2)属于TIM基因家族。TIM-3是一种Ⅰ型膜蛋白,由281个氨基酸组成。它由一个胞外区、一个单跨膜结构域和一个C-末端细胞质尾部组成。TIM-3作为一种负调控的免疫检查点,存在于不同类型的免疫细胞中,包括T细胞、NK细胞、单核细胞、巨噬细胞和DCs。
TIM-3可以和不同配体结合来调节抗肿瘤免疫,比如Galectin-9与TIM-3的糖链结合,通过诱导凋亡来调节TH1细胞免疫;HMGB1和TIM-3的相互作用,可以损害了Toll样受体和胞浆感受器介导的对核酸的先天免疫反应,从而阻碍了DNA疫苗和细胞毒化疗的效果。
LILRB
抑制性白细胞免疫球蛋白样受体(The leukocyte Ig-like receptor subfamily B ILRB)是一类一次跨膜的糖蛋白,该类蛋白的胞外区有免疫球蛋白类似(Ig-like)的结构域,胞内区域有ITIM基序(Immunoreceptor tyrosine-based inhibitory motif 基于酪氨酸的免疫受体抑制性基序)。该家族成员有LILRB1,LILRB2,LILRB3,LILRB4,LILRB5。
适应性免疫细胞上的免疫检查点
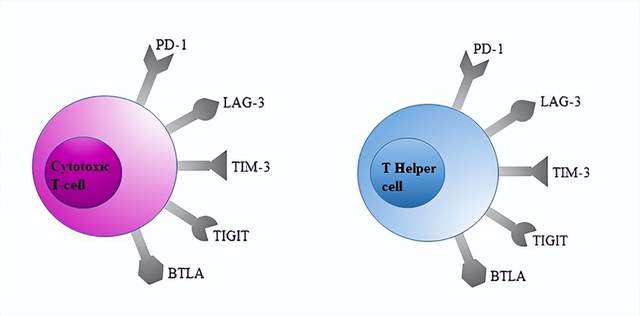
适应性免疫细胞上的免疫检查点
PD-1
PD-1(程序性死亡受体1, PD-1)是一种已经被广泛应用于临床治疗领域的免疫检查点。它主要表达于活化的CD4+和CD8+T细胞上。在未刺激全血中分别约占33%和31%。此外,它可以在B细胞、NKT细胞、树突状细胞和单核细胞中表达。但人类NK细胞是否表达PD-1还存在一定争议。到目前为止,FDA已经批准了三种PD-1抑制剂:Nivolumab, Pembrolizumab和Cemiplimab,以及三种PD-L1抑制剂:Atezolizumab, Avelumab, Durvalumab。
CTLA-4
CTLA-4(即细胞毒性T淋巴细胞相关蛋白4,又称CD152),是T细胞(胸腺依赖性淋巴细胞)上的一种跨膜受体,作为免疫检查点起作用并下调免疫应答。CTLA-4通过与抗原细胞表面的受体结合,从而起到开关作用,终止免疫反应。而CTLA-4抑制剂通过抑制CTLA-4分子,则能使T细胞大量增殖、攻击肿瘤细胞。Ipilimumab是迄今为止FDA批准的唯一的CTLA-4抑制剂。
LAG-3
LAG-3(淋巴细胞激活基因-3,又名CD223)是一种免疫检查点受体蛋白,主要表达在活化的T细胞、NK细胞、B细胞和浆细胞树突细胞。
TIGIT
TIGIT(T cell Ig and ITIM domain, 也称为WUCAM,Vstm3,VSIG9)是脊髓灰质炎病毒受体(PVR)/Nectin家族的成员。TIGIT在CD4+T细胞、CD8+T细胞、NK细胞和Treg细胞中表达,通过多种机制抑制固有免疫和适应性免疫。
TIGIT能够抑制CD155介导的CD226激活。参与TCR信号通路激活和T细胞和NK细胞肿瘤识别。在健康个体中,未受刺激的全血样本中约13%的CD4+T和24%的CD8+T细胞表达TIGIT。TIGIT会在受损的CD8+T细胞上调,双阻断TIGIT和PD-1可以部分恢复CD8+T细胞的能力。另外TIGIT在NK细胞上的表达有较大的个体间差异,在20%-90%之间,平均为62.57%,其中在CD56dimNK细胞上的表达高于CD56 brightNK细胞。
BTLA
BTLA(CD272)是一种重要的共抑制受体,BTLA属于CD28家族,与PD-1和CTLA-4具有结构相似性。它具有细胞外免疫球蛋白结构域、免疫受体酪氨酸抑制基序(ITIM)以及免疫受体基于酪氨酸的开关基序(ITSM)。BTLA信号转导包括ITIMs的磷酸化和含有SH2结构域的磷酸酶1(SHP-1)/SHP-2结合,从而抑制T细胞增殖和细胞因子的产生。
Siglec-7
唾液酸结合免疫球蛋白样凝集素(Siglecs)是一种免疫调节性唾液酸结合受体,属于I型凝集素家族。siglec7在NK细胞、单核细胞、巨噬细胞和中性粒细胞中表达 。与经典NK细胞抑制受体NKG2A/CD94和KIRs类似,抑制性siglec在其胞内段C端也含有一个或多个ITIM和ITIM样基序。连接后,ITIM被Sr家族激酶磷酸化,招募并激活Src同源(SH2)结构域的蛋白质,主要是酪氨酸磷酸酶SHP1和SHP2或细胞因子信号转导蛋白的抑制因子(SOCS3)。
免疫检查点阻断的影响因素
过去十年,免疫检查点阻断(ICB)在治疗癌症方面取得了很大进展。然而,ICB治疗仅对一部分患者有效。因此,研究影响ICB反应和毒性的宿主内在和外在因素十分重要。
宿主内在因素
肿瘤和肿瘤微环境:包括CD4+T细胞,CD8+T细胞,Treg细胞,骨髓来源的抑制性细胞(MDSCs),中性粒细胞,肿瘤相关纤维母细胞(CAFs),组织特异性基质,代谢和信号途径,TMB和表观遗传缺陷,肿瘤微生物,肿瘤内皮组织,新抗原和胞外囊泡(EVs)等。
宿主基因组学和表观基因组学:包括CTLA-4多态性,HLA杂合性等。
系统性免疫:包括免疫抑制性表型,抗原刺激,外周免疫细胞等。
系统性因素:包括儿茶酚胺,性激素,其他激素,年龄,性别,肥胖等。
微生物组:包括肠道微生物,口腔微生物,循环微生物等。
宿主外在因素
环境暴露:包括食物和水质污染,化学和工业暴露,居住环境暴露,空气污染,UV辐射,宠物等。
社会心理因素:包括种族不平等,抑郁/焦虑,心理和精神压力,社会经济不平等,性别歧视等。
生活方式:包括吸烟,吸毒,药物治疗,外科手术,体育活动,酒精摄入量,饮食和膳食补充等。
微生物因素:包括病毒,病原微生物,居住环境微生物污染,环境非致病性微生物等。
需要特别说明的是,对宿主内在和外在因素了解的不断增加,证实了其相互作用的高度复杂性。在ICB应答过程中,这些因素对个体和整体具有何种意义,我们仍然知之甚少。多项研究已经开发了框架和数学模型,以更全面的了解肿瘤免疫以及ICB应答,为治疗决策提供帮助。
肿瘤和抗肿瘤免疫的共同进化
在抗肿瘤免疫治疗的背景下,肿瘤和免疫微环境的共同进化具有重要的临床意义。随着时间的推移,了解这些共同进化,有助于明确ICB耐药机制。
肿瘤进化:由正常组织、癌前病变,逐渐向侵袭性肿瘤、晚期及转移性肿瘤进化。接受ICB治疗后,可从应答向耐药进化。
肿瘤内在因素:由低突变负荷、低频病原微生物组,逐渐向突变负荷升高、多克隆性、信号和代谢通路激活、PD-L1表达、胞外囊泡释放、促肿瘤免疫细胞聚集、低氧状态、肿瘤基质激活、高频病原微生物进化。
肿瘤外在因素:由不存在系统免疫缺陷、低系统性炎症、致癌物质无或低水平暴露、高纤维饮食、肠道微生物生态平衡,逐渐向免疫抑制状态、系统性炎症、致癌物质高水平暴露、低纤维饮食、肠道微生物失衡进化。
人体免疫系统具有一套复杂的平衡系统,对病原体(或肿瘤)提供有效应答的同时,保持自身非肿瘤组织和共生物的耐受性。ICB会破坏这种稳态平衡,导致自我耐受性的丧失以及错误的、非肿瘤导向的免疫反应,从而引起irAEs(免疫相关性毒副反应)。
目前我们对于irAEs的发生、发展机制尚未完全了解。目前公认的有六种机制,分别是:
自我耐受性的丧失,表现为自体反应性T细胞和B细胞的激活;
分子模拟学说,即自体组织肽模拟;
抗原表位扩展,即肿瘤细胞死亡后释放了额外的抗原(可能是自身抗原),T细胞和B细胞被激活,从而攻击正常组织;
局部或系统性炎性细胞因子的改变;
直接的细胞毒性作用,这也是垂体功能障碍的可能机制;
亚临床炎症,先前存在的感染或自身免疫性疾病的炎症会被放大。
肿瘤免疫治疗的诞生,能使部分原本治疗选择有限的患者获得长期生存。可惜的是,能获益的患者数量仍然有限。充分了解宿主内在和外在因素在ICB治疗中所发挥的作用,能有助于解决ICB治疗的局限性,从而改善疗效,给患者带来真实获益。
文章来源:SIBI创新药产业