产品中心
技术交流

扫描二维码
逐典分享丨基因治疗:AAV的前世今生

AAV最早于20世纪60年代中期从实验室腺病毒制剂中被发现,随后很快在人体组织中找到。此后的15到20年间,一些研究小组对AAV进行研究,AAV的生物学特性也逐一被揭晓,包括AAV的基因构型和组成、DNA复制和转录、感染潜伏期和病毒颗粒包装,这些研究结果共同促进了野生型AAV2序列成功克隆到质粒中,实现了基因研究和整个AAV2基因组测序,为AAV作为基因递送载体提供了基础知识。
1984年,首个用于基因递送的rAAV载体问世,随后rAAV载体设计有了进一步的发展并开始在体内应用。1994年和1995年分别实现了体内的持续表达和在人体中的应用。2002年开始,更多的衣壳陆续被发现。2008年,rAAV载体在临床上有了一定的疗效。近十年来,基于AAV的基因治疗药物有了重大突破,,相关药剂分别于2012年和2017年被EMA和FDA认证。现如今,rAAV已成为基于治疗递送的主要平台。
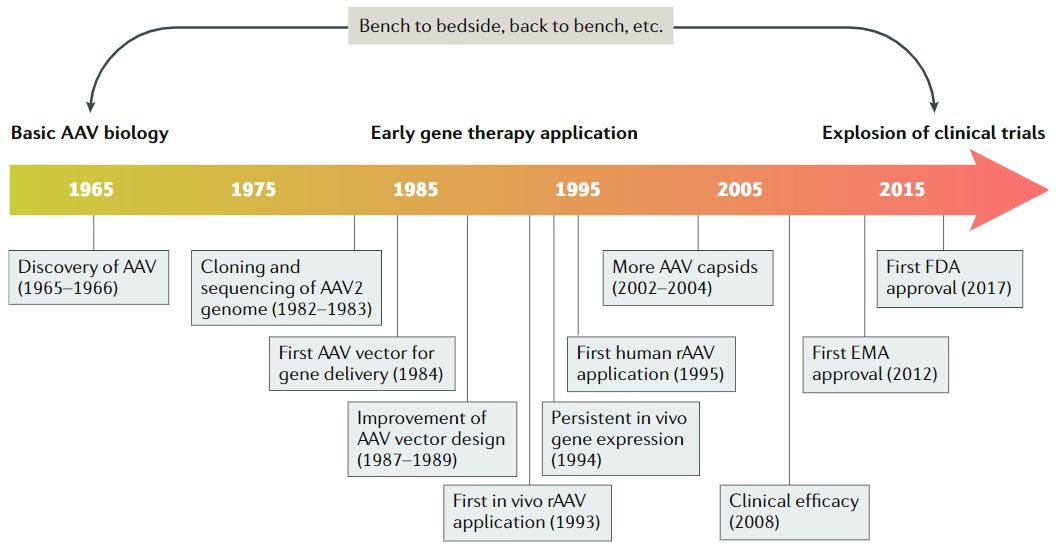 图1. AAV 50年的发展历程
图1. AAV 50年的发展历程
AAV属于细小病毒科,是复制缺陷型病毒,结构简单,是一个由直径约26nm的无被膜二十面体蛋白质衣壳和~4.7kb的单链DNA基因组组成。野生型AAV基因组的两端分别是一个T型的反向末端重复序列(ITR),是病毒复制的起点和包装信号。ITR序列之间为病毒编码区,含有rep基因和cap基因。rep基因编码与病毒复制相关的四种蛋白质,分别是Rep78、Rep68、Rep52和Rep40。cap基因则编码三个衣壳亚基,分别为VP1、VP2、VP3,共60个拷贝,比例为1:1:10。每个亚基在病毒粒子表面有9个可变区域,它们决定AAV载体的主要取向和细胞内运输,通常为NAbs识别的区域。
此外,cap基因还编码组装活化蛋白(AAP),可以促进病毒的包装。而rAAV是在非致病的wt-AAV基础上改造而成的基因载体。rAAV的基因组删除了全部的AAV蛋白编码序列,只保留了wt-AAV的ITR,以保证rAAV的包装能力的最大化,且有助于它们在体内递送时的低免疫原性和细胞毒性。
图2. AAV的结构和基因组
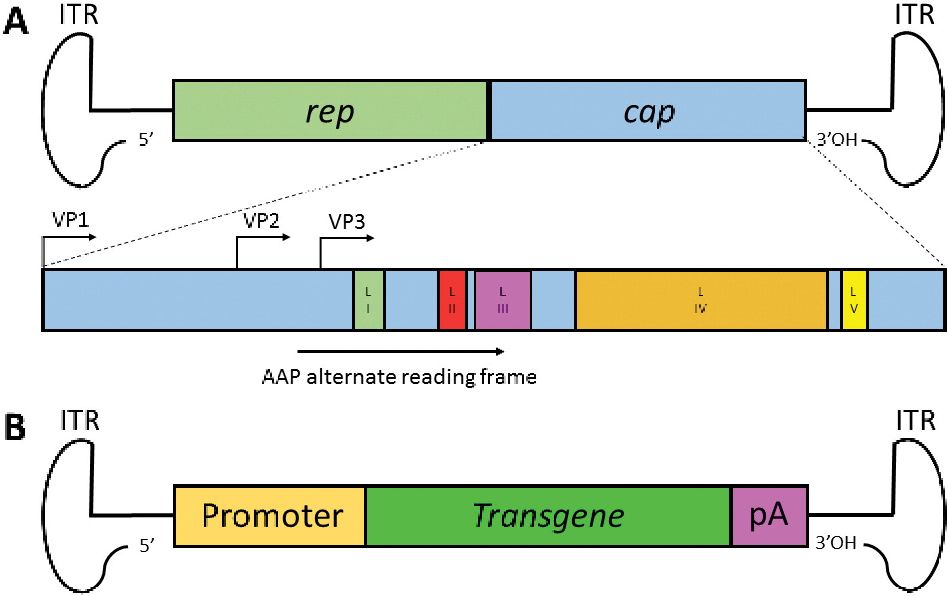
图3. AAV的结构和基因组
在进行rAAV的基因组设计时,有几个方面需要注意。
其一,是控制转基因表达水平和特异性,在大多数情况下,rAAV的基因治疗平台利用强大且普遍存在的启动子以实现高效转基因表达,比如通用型启动子:CAG、CMV和CBA。此外,组织特异性强启动子、插入基因的天然启动子和靶向特定细胞亚群的合成启动子亦成为新起之秀。然而,转基因序列本身的元件也会影响其表达,因此有必要对密码子进行优化。值得注意的是,蛋白质或RNA分子的超生理表达可能会产生毒性作用;非靶组织或细胞类型中的基因表达亦可能导致毒性或引发不必要的免疫反应。
其二,AAV载体的一个局限性是它的小包装尺寸,rAAV最多可装载5.0kb以下的基因组。目前最具潜力的两种方法是微基因策略和双载体-PTS法,前者已发展到临床试验,而后者仍处于临床前发展阶段,重组效率限制了其应用。
其三,由于rAAV是非复制性的附加体,转导的载体基因组随着有丝分裂逐渐消失,因此,在复制型细胞中保持转基因表达显得尤为重要。在复制型细胞中实现持续表达可通过靶向基因组整合的方法,但如果核酸酶也被用于切割rAAV基因组,则可考虑无核酸酶同源定向整合的方法,通过在载体基因组中插入与基因组同源的侧翼序列片段来实现稳定的序列整合。
常用的rAAV包装系统有两种。三质粒系统由包装质粒、真核表达质粒和辅助质粒组成。包装质粒主要表达Cap和Rep蛋白;辅助质粒主要提供AdV辅助功能;真核表达质粒则携带目的基因和AAV的ITR。两质粒系统则是将包装质粒和辅助质粒合并为一个质粒。将三质粒或两质粒共转染293细胞,进行病毒的复制和包装。
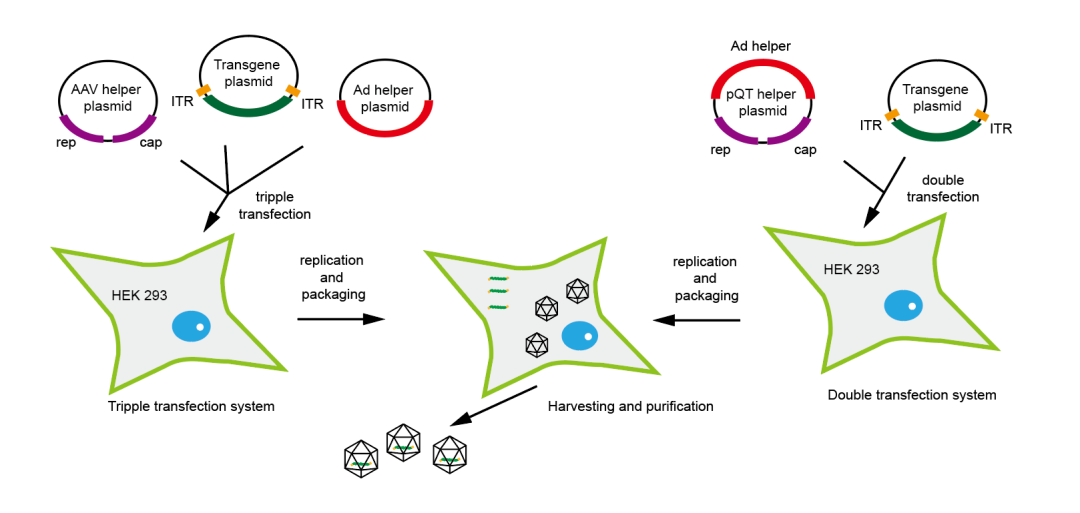
图4. rAAV的包装系统
rAAV颗粒进入体内,首先与细胞表面的糖基化受体结合,然后通过网格蛋白的内吞作用进入细胞。包裹着病毒颗粒的核内体在细胞质中进行一系列的酸化后,病毒衣壳的VP1/VP2发生构象变化,导致病毒从核内体中脱离出来,经过核孔进入细胞核,或通过蛋白酶体进行蛋白质的分解。进入细胞核的病毒颗粒,其单链DNA从衣壳中释放出来,此时单链DNA不能进行转录,需成第二链再转化为双链DNA才可进行转录。因此,可将其设计成自互补AAV(scAAV),以增加其转录效率。

图5. 转导通路
迄今为止,在临床试验中使用的AAV载体中,使用频率最高的是AAV2,主要集中于眼、肝脏、横纹肌和中枢神经系统。
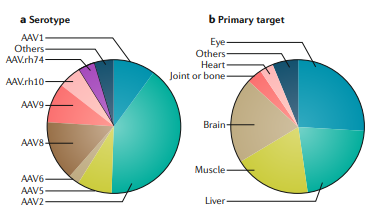
图6. rAAV介入性基因疗法的临床试验概况
rAAV的治疗策略分为四种。首先,基因替换,旨在提供基因产物以补偿功能丧失性突变;其次,基因沉默,主要解决由获得性功能突变引起的单基因疾病;再者,递送新基因,可用于处理遗传疾病和后天性疾病,此外,可通过rAAV递送编码重组抗体的基因来中和致命病毒感染;第四,基因编辑,通过目标DNA断裂和DNA修复可直接修复人类疾病的相关突变。
目前,rAAV仍面临着许多挑战,如,大规模制造的高成本导致了药物价格的高昂,药物产品的可负担性已成为基于病毒的基因疗法的阻碍之一;缺乏对病毒载体转染效率的把控及评估的标准方法;rAAV蛋白衣壳、DNA基因组和转基因的蛋白质产物均可与宿主免疫系统相互作用,阻碍基因的有效递送和持续表达。
第一个屏障涉及中和抗体(NAbs),NAbs可结合到载体病毒粒子的表面,以阻碍病毒粒子与靶细胞相互作用并进入细胞,并阻碍rAAV在细胞中的有效递送和基因组的脱壳。进入细胞质内的病毒粒子在核内体中降解后,其基因组或衣壳暴露于TLR9或TLR2等受体,通过MyD88驱动途径触发先天性免疫应答。而成功从核内体释放并进入到细胞质中的病毒粒子,其衣壳在蛋白酶体中被降解为小肽和表位,这些小肽和表位被装载在MHC I类分子上,呈现在靶细胞表面,最终使靶细胞被识别并被CTL反应所消除。到达细胞核的病毒粒子脱壳后,转录发生,生成正负链的RNA,输出到细胞质中形成dsRNA,dsRNA被传感器MDA5/RIG-1识别,激活先天性免疫反应。转基因表达后,错误折叠的蛋白质在蛋白酶体中被降解。产生的小肽和表位再次结合MHC I类并触发CTL反应。最后,治疗产物被分泌到循环中,通过抗原提呈激活B细胞,通过体液免疫中和治疗蛋白。
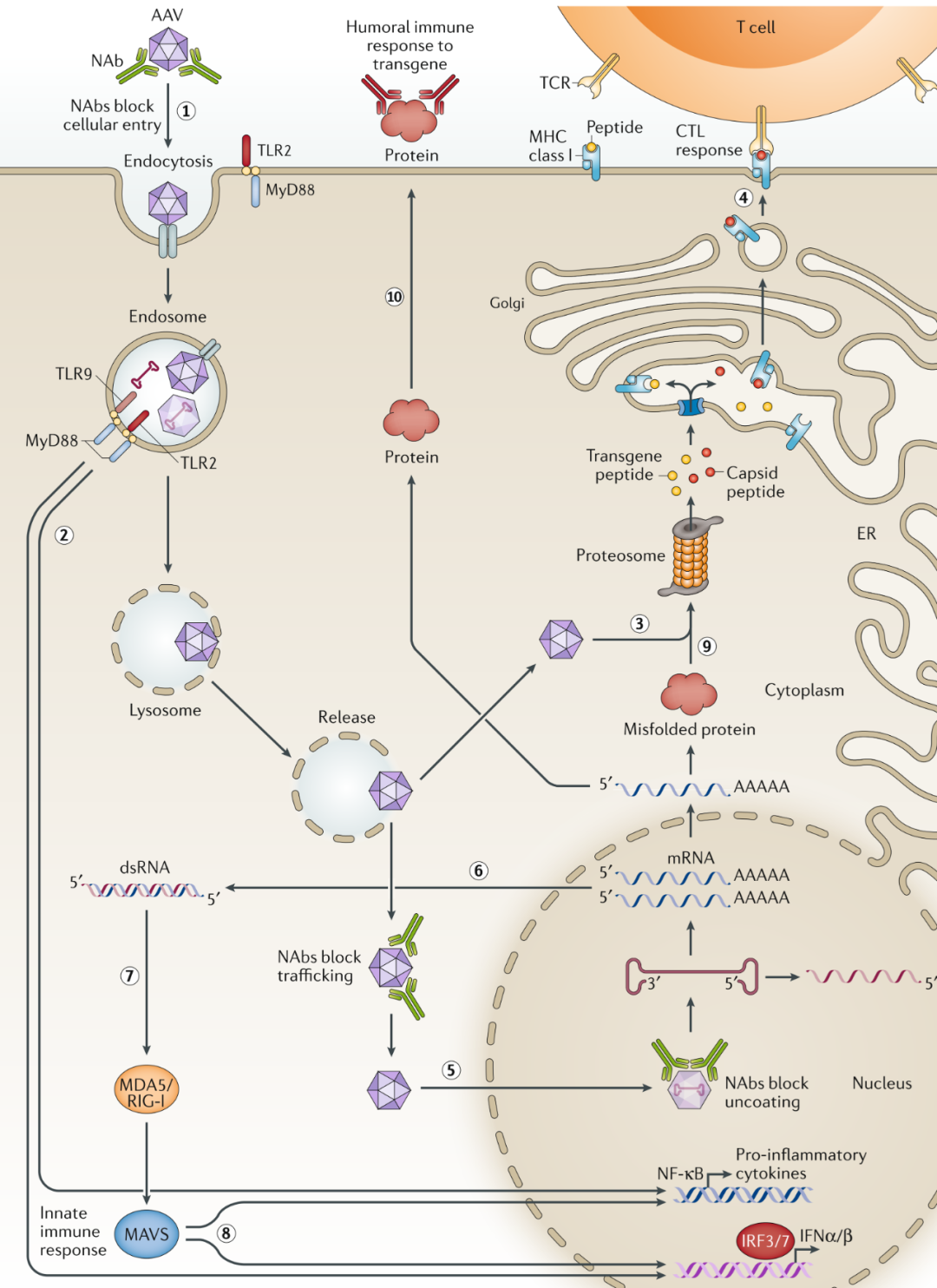
图7.影响rAAV基因治疗的免疫学障碍
来源:细胞与基因线路设计
* 推文用于传递知识,如有版权等疑问,请联系我们。
咨询热线:苏经理18521301252
技术咨询:李经理15121038345
销售咨询:李经理18768160320
渠道合作:顾经理13564627120
更多精彩内容,请点击上海逐典生物官网了解~
