CAR-T疗法是近年来最成功的转化医学之一,随着2021年国内两款CAR-T细胞制品的上市,这一领域的临床和基础研究正迅速扩大。与CAR-T细胞相关的关键挑战包括细胞因子风暴、限制转运、浸润和激活肿瘤、在体内的持久性、抗原逃逸和异质性以及制造问题。由此衍生出大量的研究活动来设计新的CAR结构,以增加靶向癌症的范围和抗肿瘤疗效。
PART01
CAR结构迭代历史
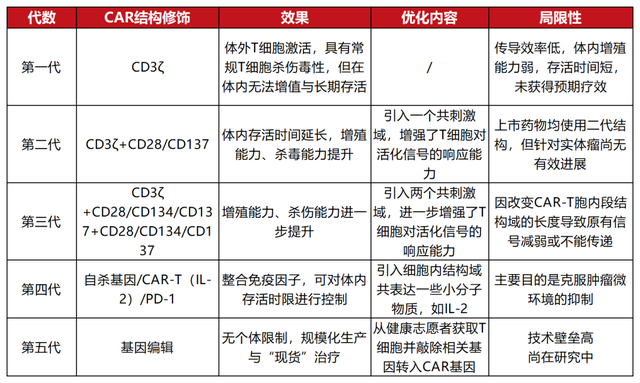
五代CAR结构发展盘点
上图盘点了CAR结构从出现到优化的发展历程,其中第四代、第五代CAR结构仍有部分内容存在争议。目前,CAR的模块化设计主要包括有四个主要部分,分别是抗原结合域、铰链、跨膜结构域和胞内信号结构域,每一种组件都有其独特的功能。作为CAR-T细胞疗法的“核心”,超越传统的模式的CAR设计一直是CAR-T细胞治疗领域寻求突破的一个重要方向。这对扩展CAR-T细胞更广泛的应用、提高CAR-T细胞安全性、有效性和适用性都具有重要意义和潜力。
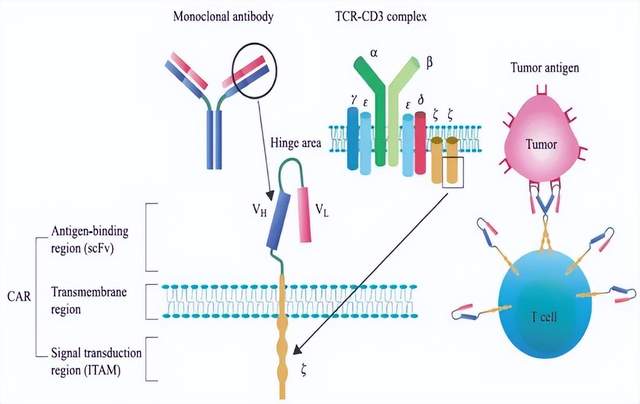
CAR结构示意图
PART02
新型CAR结构设计
除了对“经典”CAR结构部件的修饰之外,研究还探索了先进的设计策略。这些方法在如何设计T细胞以及如何指示它们响应抗原的功能方面存在着根本差异。
双CAR
抗原丢失或抗原“低”克隆的出现是CAR-T治疗后疾病复发的主要原因。已经确定的抗原逃逸机制包括通过自发突变和杂合性丧失来下调CD19、CD19mRNA的选择性剪接、谱系转换或抗原逃逸。因此靶向多种癌症抗原可能会阻止或减少单一抗原逃逸的快速出现。
目前可以采取多种方法设计靶向两种抗原的CAR-T细胞产品:联合用药,包含两个分别靶向不同抗原的CAR-T细胞群;双CAR设计,其中T细胞被设计为表达两种不同的CAR,其中CAR分子本身包含两个scFv如下图所示。
利用CAR-T细胞靶向多种抗原的策略
从广义上讲,与单抗原靶向CAR相比,这些双CAR靶向策略往往表现出增强的功效,这主要是由于最大限度地减少了单抗原逃逸。虽然临床研究证明了疗效,但与传统的单一抗原靶向相比,仍难以得出关于这些产品的相对效力结论。
双CAR产品可以在多个方向进行设计,哪种设计最好可能因目标而异,需要个性化优化。例如,在设计用于CD19和CD22的双CAR时,研究人员发现将CD22scFv置于膜远端位置可提高体外对CD22+细胞的抗肿瘤效力,但该CAR的体内活性不足。
除了双CAR外,有研究还探索了三CAR系统,最突出的例子是靶向CD19、CD20和CD22。该三CAR-T细胞被证明可以杀死所有表达单一抗原的肿瘤系,并且在表达所有抗原时超过标准抗CD19CAR的活性。此外,三CAR-T细胞能够在体内控制CD19阴性肿瘤。诸如此类的方法对于抗原逃逸是重要障碍的疾病非常有吸引力。
门控CAR
➤ “AND”门
细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)是CAR治疗常见的不良反应,其发生率因产品和疾病相关。除此之外,不良反应还包括可能存在的细胞毒性。因此,调整CAR驱动的T细胞功能以降低上述不良反应是临床目前的迫切需求。
为了限制毒性,研究人员设计了控制CAR响应抗原激活的方法。其中一种方法是使用“AND”门控CAR。在该设计中,T细胞被设计为表达针对两种抗原的两个单独CAR,类似于上述双CAR。一个CAR仅包含CD3ζ信号域,另一个包含共刺激域。初级和次级信号事件发生在反式而不是顺式,允许T细胞仅通过区分恶性组织和健康组织的独特抗原呈递模式而被激活。
“AND”门控CAR示意图
尝试将这种策略应用于表达CD19和前列腺特异性膜抗原(PSMA)的细胞还表明,反式激活对于T细胞功能对抗表达单一抗原的癌症并不是必不可少的。
另一个研究方向则是将其靶向间皮素(包含CD3ζ)和α叶酸受体(FRα,包含CD28)。这些抗原通常在卵巢癌中共表达,但不在健康组织中表达。研究发现,在体内“AND”CAR比第一代CAR更好地控制了双阳性肿瘤,并且与第二代CAR顺式信号传导相当。
➤ “NOT”门
与“AND”门控CAR类似,“NOT”门控CAR也试图限制细胞毒性T细胞的“靶向、非肿瘤”毒性。“NOT”门控电路将传统的第二代CAR与用于识别健康组织上表达的表面蛋白抑制性受体结合,而不是依赖于通过识别多个不同肿瘤抗原提供多个信号的整合。现有的CAR-T工程策略无法区分破坏性和有效的T细胞功能。“NOT”门控CAR有可能抑制由正常组织驱动的T细胞活性,同时保留针对肿瘤细胞的效应功能。
“NOT”门控CAR示意图
在“NOT”门控CAR的概念验证报告中,抗PSMA scFv与CTLA-4或PD-1的免疫抑制域融合,并与抗CD19CAR同时表达。在同时表达PSMA和CD19的细胞存在情况下,CTLA-4信号能够将CD19CAR产生的细胞毒性降低67%,而PD-1信号能够将毒性降低91%。
重要的是,当这些“NOT”门控CAR-T细胞二次暴露于CD19+单阳性肿瘤时,它们能够增殖和杀死靶标以及之前未被抑制的细胞。这一发现表明,“NOT”门控CAR活性是可逆的,因此能够控制不利的细胞毒性作用,但仍保留过继转移T细胞的治疗潜力。
装甲CAR
“装甲CAR”广泛用于包括将CAR表达与免疫调节蛋白分泌相结合的工程方法。这些方法中研究最充分的是细胞因子分泌,这些细胞因子可以支持T细胞功能或影响肿瘤微环境,也包括检查点抑制剂和双特异性T细胞接合物的分泌。
IL-12通常由髓系细胞分泌,用于促进T细胞沿Th1途径分化。临床前研究表明,靶向CD19的CAR-T细胞组成型表达IL-12可增强抗白血病功效。使用IL-18和IL-15的类似研究证实了该平台在增强CAR驱动反应以及吸引非CAR免疫细胞方面的功效。
“BiTE”装甲CAR示意图
与直接增强T细胞功能相反,使用装甲CAR也可以逆转T细胞抑制。免疫“检查点”是T细胞表面蛋白,能够抑制T细胞与靶细胞之间的活化相互作用。例子包括CTLA-4和PD-1。最近的一项临床研究证明了PD-1抑制剂和靶向间皮素CAR-T细胞在间皮瘤患者中的安全性,证实检查点阻断与CAR-T细胞的组合是安全的,并且可能具有协同作用。
PART03
小结/SUMMARY REPORT
随着我们获得CAR-T产品的临床经验,早期评估它们在治疗中的应用,探索它们作为造血细胞移植的替代或桥梁治疗的潜力,并将它们与其他治疗方式相结合,它们在癌症患者治疗、护理中的作用将会日益增长。
目前的CAR产品对实体肿瘤没有理想的疗效,这为新型CAR结构设计创造了机会。蛋白质和基因组工程的进展现在允许对细胞功能进行复杂的操作。调整CAR的基本框架和添加其他调节蛋白,使其具有更精确的功能,无疑代表着免疫细胞工程新时代的开始,这将为更多的癌症患者提供更持久、更有效的治疗
来源:IBI生物创新药博览会
* 推文用于传递知识,如有版权等疑问,请联系我们。





