产品中心
技术交流

扫描二维码
单克隆性确证:生物治疗领域的关键监管要求
自 1986 年 FDA 批准第一种重组蛋白以来,多年来批准的生物制药的数量不断增长,这反映了它们在现代医学中的重要性[1]。到 2021,FDA 批准了 100 个单克隆抗体产品[2]以及其他 9 种新的生物药物,占当年批准药物总数的 16%[3]。生物制药市场 35 年的稳定增长模式反映了这些药物是治疗多种疾病最有效的临床治疗方式之一;因此,几乎所有医学分支都越来越多地使用它们[4]。
生物治疗是一种尖端药物,其靶向人体中特定的分子,这些分子参与广泛传播的疾病(包括癌症、免疫和代谢紊乱)[5]。哺乳动物细胞系,如中国仓鼠卵巢细胞(CHO)和人类胚胎肾 293 细胞(HEK 293),是用于生产重组DNA(rDNA)来源的人类治疗蛋白的最常见平台。这些细胞系被设计为携带编码所需蛋白质的基因,是生物技术公司拥有的最重要资产。因此,公司需要确保这些产品的安全性、纯度和性能,并限制生产过程中的可变性,以确保最终产品的一致性。
可能影响工艺一致性和产品质量的一个主要因素是细胞系的克隆来源或单克隆性[6]。 “简而言之,单克隆性基本上是从单个细胞开始的细胞系,”Advanced Instruments 高级业务拓展经理 Andrea Gough 解释道无论您想要制造重组抗体、病毒载体、疫苗还是诱导多能干细胞(iPSC),建议从同质的单克隆来源的生产细胞系开始,以降低过程可变性和患者的潜在风险。” 特征良好的单克隆衍生细胞系不仅是生物制药生产过程的基本组成部分,也是向监管申报的要求,最典型的是在研究新药(IND)申报阶段。事实上,单克隆衍生可以影响产品的关键质量属性[7]。因此,生产细胞系的单克隆性的证明至关重要,并且应在细胞系开发期间尽早确认。Gough 继续说道:“多个监管机构越来越严格,需要更详细的 MCB 单克隆性证据。”“因此,公司的目标是在开发过程的早期就开始对细胞系做单克隆,并尽快获取所需的证据。”事实上,作为总体控制策略的一部分,监管机构要求所有生物生产细胞系“从单个细胞的起源细胞开始克隆”,以确保安全性和产品质量一致性[8]。美国(FDA)和欧盟(EMA)在生产细胞系的单克隆来源方面对生物治疗药物的生产有不同也有类似的指导方针(见表1)。
生物治疗药物生产指南 1998 年由国际人类使用药物技术要求协调委员会(ICH)发布的“ICH Q5D 指南”指出,“对于重组产品,细胞基质是含有所需序列的转染细胞,该序列是从单个细胞的起源细胞克隆而来的[9]。” 1997 年发布的 FDA 指南《人用单克隆抗体产品的制造和测试要点》指出,“主细胞库(MCB)定义为源自单个组织或细胞的单一组成细胞的集合[10] 。” EMA 于 2016 年发布的“单克隆抗体和相关产品的开发、生产、表征和规范指南”指出,“用于生产单克隆抗体的细胞基质应是通过重组DNA和/或其他合适技术开发的稳定、连续的单克隆细胞系[11] 。” 2013 年发布的世界卫生组织“技术报告(TRS)978 ”指出,“对于通过重组质粒 DNA 技术转染获得的蛋白质,只要在整个生产过程中以及生产过程以外的特定细胞年龄内证明产品同质性和一致性特征,一轮完整的克隆就足够了[12]。” 表1
Gough 表示:“单克隆性的重要性与产品的稳定表达有关,如果药物批准后出现任何供应问题,患者可能面临风险。因此,监管要求中强调了这一点。” “尽管 CHO 细胞系被认为是一种非常强健的细胞系,自 20 世纪 80 年代以来一直被用于生物治疗药物的生产,但其基因组是相当‘可塑性’的,可以随时间变化的,因此从单个 CHO 细胞开始可以帮助降低风险。”事实上,这种不稳定性和染色体异质性会影响细胞生长、产率和产品质量[13]。
单克隆性确证降低了异质细胞群体变化的可能性,从而降低了供应问题的风险,最终也降低影响患者健康的风险。Gough 解释道:“对生物技术/制药公司来说,最糟糕的情况是药物上市后出现生产问题。” “如果公司无法供应药物,这可能会对等待治疗的患者产生重大后果。将对患者健康的风险降至最低也是监管机构的重要考虑因素。”
为了产生单克隆衍生的细胞系,需要分离、培养和扩增单个前体细胞。传统的方法执行这一亚克隆步骤是有限稀释(LD),这是在 20 世纪 80 年代初开发的,用于克隆单克隆抗体生产中的杂交瘤细胞系[14]。Gough 解释道:“有限稀释是指将细胞在细胞培养基中大量稀释至理论浓度为 0.5 个细胞/孔,然后再进行铺板和扩增。” “这种方法是基于概率的:你希望每个孔的细胞浓度如此之低的原因是为了避免有许多孔含有两个细胞或没有细胞。如果你从一个更高的目标浓度开始,例如每个孔一个细胞。”事实上,LD 依赖于一种概率方法,该方法提供了相对较高的所产生细胞系单克隆衍生的统计概率,特别是在进行第二轮克隆时(见表 2)。此外,显微评估可用于目视确认孔中是否存在单个细胞。尽管这是一种相对廉价的工艺,但 LD 劳动密集、耗时、速度慢且产量低;科学家之间的差异也很大,显微镜观察也没有报告。此外,潜在的统计考虑是基于用珠子而不是细胞进行的研究,没有考虑到细胞不像珠子那样的行为,因为它们往往粘在一起。因此,即使进行双轮克隆,也可能无法完全保证基因同源性。
有限稀释,例如每孔 0.5 个细胞 假设1-细胞按照泊松分布分布 每孔细胞数 0 1 2 3 4 5 油孔数量% 61% 30% 8% 1% 0% 0% 在每孔 0.5 个细胞的接种密度下,39% 的孔含有细胞,其余的孔将是空的。 所有细胞都有同等的存活和生长机会。 来自 1 个细胞的克隆 77% 来自 1 个以上细胞的克隆 23% 在 39% 含有细胞的井中,77% 含有 1 个细胞,23% 含有 1 个以上细胞。 假设3-第二轮有限稀释具有很高的单克隆可能性。 1 轮后的单克隆概率 77% 2 轮后的单克隆概率 95% 单克隆概率是根据 Coller 和 Coller 的工作(参考Hybri-doma,1983 2:91-96)和以上 3 个假设。 表2
最近的技术进步大大改进了克隆选择系统。在现代克隆方法中,使用专门的仪器来确保将单个细胞接种到微孔板的每个孔中。流式细胞术(FACS)最初是作为一种研究工具开发的,现在允许基于定义的细胞表面标记物的表达来检测和选择细胞[15]。“FACS 是一项众所周知的技术,”Gough 说这是一种高效、高通量的方法,因为它可以在相对短的时间内筛选数百万个细胞。然而,它需要很高的技术专业知识,并且当以极高的速度和压力将细胞推过分选系统中的一个非常小的孔时,它们必须承受高的机械应力。”事实上,由于这种剪切应力,许多选择的克隆不能在选择过程中存活,因此生长率很低。此外,为了检测,需要用荧光染料标记细胞,该荧光染料可能对所选细胞克隆的生长和扩增产生负面影响,并且在体内产生不希望有的副作用。 对更温和流体的需求和与 LD 方法的挑战推动了新的低压自动铺板方法的发展。自动单细胞铺板设备,如Advanced Instruments VIPS 单细胞铺板仪,使用基于图像的细胞识别方法,通过每个孔中滴入单个细胞,并立即在孔中原位成像确认是单个细胞。这种仪器的铺板效率为 70-85%,随细胞类型的不同而不同,远远高于 LD(30%)(见表3)。
有限稀释 FACS VIPS 铺板效率 30% 90% 70-80% 筛选 1000 个细胞需要 96 孔板的数量 50 10 10 效率 低 高 高 生长率 高 低 低 表3
VIPS 单细胞铺板仪
VIPS 单细胞铺板仪为 LD 和 FACS 提供了有效的替代方案。“这种具有集成成像功能的铺板设备可以让科学家拍摄滴入孔中的单个细胞的照片。它比 FACS 更温和,不会损坏选定的细胞,然后这些细胞可以生长和扩增。”
由于监管机构需要大量详细信息来评估克隆过程,生物技术和制药公司需要提供严格的单克隆性证明。因此,他们需要有效的数据,如图像,以记录细胞库生成过程中发生的情况。Gough 解释道:“在接种时、沉降后(24 小时内)以及随后的克隆扩增过程中,孔板的显微成像对于确保细胞系的单克隆衍生是有价值的。” “VIPS™ 将细胞接种过程与液滴图像和第 0 天全孔图像相结合。干孔中液滴图像提供了单细胞分离成功的证据。”这种实时可视化评估可减少实验操作,显著提高工艺效率。 尺度:200 µm 此外,现代成像技术监测细胞系生长,对于免疫球蛋白等简单分子,通常需要 14 到 21 天,对于更复杂的分子,需要 28 天。Solentim Cell Metric® 提供全孔高对比度成像,以确认第 0 天存在单个细胞,并在整个培养期间进行每日成像。Gough 说:“成像设备在第 0 天捕捉到整个孔的图像,因此你可以看到是否是单个细胞。” “然后,他们会定期拍照,让你监测单个细胞长成克隆的情况。该程序使您在不干扰细胞生长的情况下收集单克隆性的图像证据。” 当使用成像系统时,重要的是要考虑到它们的精度可能会受到诸如校准、聚焦、照明、焦深和分辨率问题等因素的影响。事实上,由于这些设备的聚焦深度有限,细胞需要位于孔底,以避免接种后几天出现假阴性克隆。此外,由于孔板生产工艺的问题,每个孔的底部在板中处于不同的高度。成像系统可以看到孔边缘的细胞也是很有帮助的。 每日全孔成像作为单克隆性证据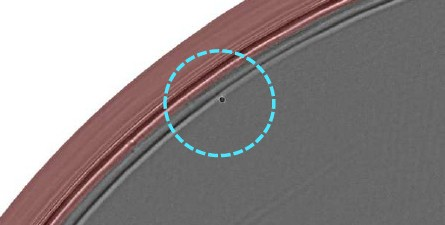


技术进步使单克隆流程得以发展。快速增长的生物制药市场需要这样准确和高效的分析流程。事实上,到 2019 年底,全世界正在进行 1000 多项以改善当今许多慢性病的生物治疗的临床试验[16],所以对生产过程的深刻了解和控制已变得至关重要。
参考文献(上下滑动查看更多)

长按或扫描上方二维码关注我们 Advanced Instruments成立于1955年,总部位于美国马萨诸塞州诺伍德,60 多年来一直致力于帮助生物制药,临床及食品饮料行业客户提升测试结果的质量,实现可信赖的实验结果,并不断提高企业的生产效率。 安达望(上海)科技有限公司是Advanced Instruments在中国依法成立的全资子公司。