产品中心
技术交流

扫描二维码
生物制品宿主核酸残留控制利器—逐典Pannarase全能核酸酶及ELISA检测试剂盒!

随着越来越多的生物制品(重组蛋白疫苗、病毒载体疫苗、细胞治疗/基因治疗药物等)进入治疗领域,生物制品的质量控制也日趋严格,其中核酸残留因其潜在的危害性,是各类质控标准的重中之重。
我国参照WHO、FDA和欧盟标准,在药典中明确规定酵母、大肠杆菌表达的生物制品中DNA残留量不超过10ng/剂量。我国2020年药典将人用狂犬病疫苗(Vero细胞)DNA残留标准更新为≤3ng/剂量。除了残留量的规定,FDA、CDE发布的相关指导文件中建议,残留的细胞宿主DNA片段不能超过一个功能基因的长度(约200bp)。
因此,在生物制品的生产工艺中必须有去除核酸残留的步骤,确保生物制品的中的核酸残留满足相应法规的要求。
逐典生物提供高品质全能核酸酶及高性能配套全能核酸酶ELISA残留检测试剂盒,灵敏度高,为生物制品解决宿主核酸残留困扰。
逐典Pannarase全能核酸酶
产品卖点:
1.无动物源性、无氨苄青霉素
2.杰出单位比酶活、更高效的核酸降解能力
3.先进的生产工艺,非传统His标签纯化、排除引入金属离子风险
4.严格的质控标准,内毒水平低,确保单位酶活的准确性以及批次间稳定性
全能核酸酶应用条件:
全能核酸酶的酶活会受到多种因素的影响(例如温度、pH、离子强度等),故用量范围也会从0.1 U/mL-250 U/mL不等。因此,不同的操作环境下酶的最佳浓度不同,需要通过实验设置梯度进行最佳条件的摸索。
应用实例:
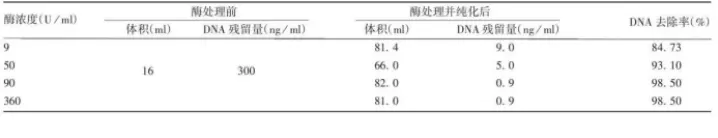
1.样品:狂犬病毒浓缩液
处理条件:核酸酶浓度50~90U/ml ,
37 ℃处理 2 h,转入18 ~ 26 ℃处理 6h

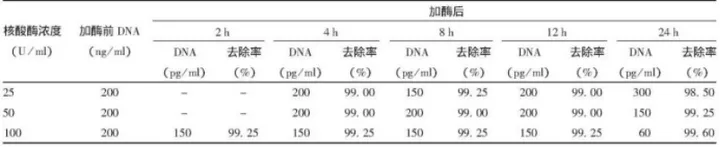
2.样品:狂犬病病毒浓缩液
处理条件:25、50和100 U/ml,37℃

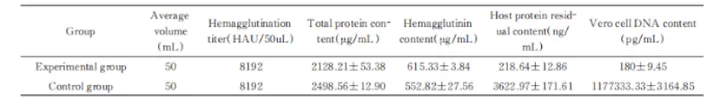
3.样品:流感病毒浓缩液
处理条件:10 U/mL,37℃

参考文献
[1] 崔燕平. 非限制性核酸内切酶对狂犬病疫苗中Vero细胞DNA的去除作用[J]. 中国生物制品学杂志, v.27(04):444-447.
[2] 刘杰,刘辉,杨会强,康庄,孙艳,毛川成,何敏,李玉华.多种方法结合去除冻干人用狂犬病疫苗中Vero细胞残留DNA[J].中国生物制品学杂志,2013,26(12):1827-1830.
[3] 阮朝列,施锦丽,李卫东等.Benzonase核酸酶在Vero细胞流感病毒灭活疫苗中的应用研究[J].病毒学报,2023,39(04):980-990.
逐典Pannarase全能核酸酶ELISA检测试剂盒
产品卖点:
1. 兼容不同品牌核酸酶
2. 灵敏度高,线性范围广
3. 抗体直接包被,批间一致性好
数据展示:
1. 不同品牌核酸酶检测
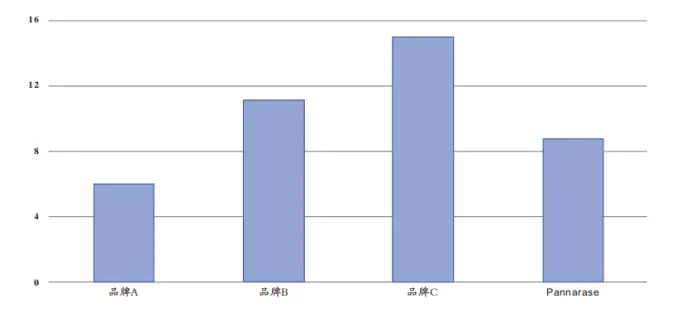
可响应市面上多种国产及进口品牌核酸酶,检测结果具有较高的稳定性和可重复性。
2. ELISA试剂盒标准曲线
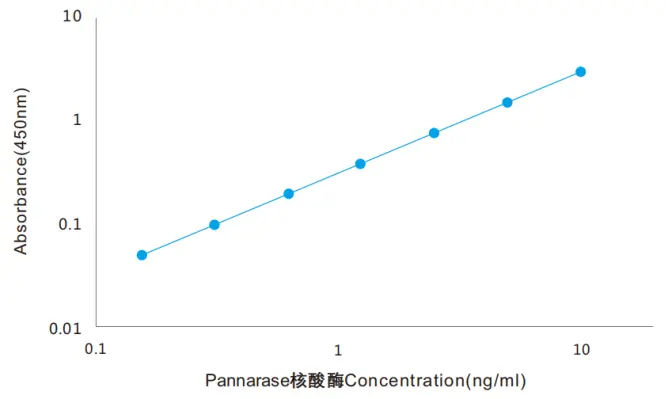
线性范围宽,从0.2ng/ml到10ng/ml,对于常规工作浓度10-20U/ml,无需重复繁琐稀释,即可检出残留量。
3. ELISA试剂盒准确性检测
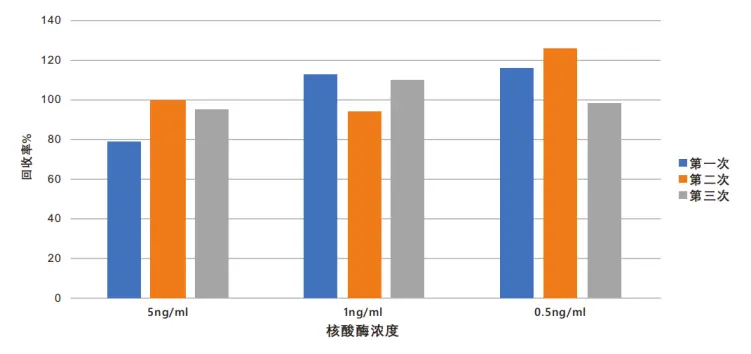
通过低中高三个浓度点Pannarase核酸酶的添加,均得到高回收率的检测数据。
4. ELISA试剂盒精密度检测
高、中、低三个浓度点下,对照品SR1(Pannarase核酸酶标准品)与1%BSA(补加Pannarase核酸酶标准品)中,CV%表现良好,均在15%以下,具有较高的精密度和重复性。