产品中心
技术交流

扫描二维码
变构抗体:抗体药物发现的新范例
本文来自于:TSS转化医学谱
变构代表了蛋白质调节的基本机制,能够从活性位点远端调节蛋白质功能。传统上是在小分子背景下进行探索,但目前变构调节作为抗体领域的主要作用模式正在受到关注,它提供了增强的特异性和降低的毒性。
这篇近期发表于【Trends in pharmacological sciences】的综述,详细深入阐述了变构抗体领域快速的发展,还探讨了这些抗体作为药物发现创新工具的潜力,并讨论了利用最先进的计算方法设计新型变构抗体的当前策略。

与变构抗体相关的定义:变构现象(Allosterism) 是在小分子世界中开始发现并发展的。然而,抗体在结构和机制上是不同的药物。因此,需要一个新的词汇来描述通过与变构位点/表位结合起作用的抗体及其作用。根据定义,变构位点/表位是一种在拓扑上不同于配体结合区域的蛋白质区域。值得注意的是,由于抗体是大分子,如果抗体与配体结合残基非常接近地结合并由于其大小而阻碍它们,则出现空间位阻,不会被视为变构。此外,抗体与属于配体结合位点的残基的结合,即使当这些残基处于非活性构象时,也不被视为变构。此外,变构作用是所有蛋白质的固有特性,不仅是受体或酶,而且是可以被抗体靶向的蛋白质配体。作者提出以下定义:变构抗体是一种与靶点/表位结合的抗体,该位点/表位与配体结合位点不重叠或空间重叠,随后对靶点的结构动力学产生影响,最终调节其结合和/或活性。负向变构抗体调节剂(NAAM,negative allosteric antibody modulator )是一种稳定并促进不利于配体、受体或共受体结合和/或活性(信号传导)的构象的抗体。正向变构抗体调节剂(PAAM,positive allosteric antibody modulator)是一种稳定并促进有利于配体、受体或共受体结合和/或活性(信号传导)的构象的抗体。抗体介导的变构效应是对靶蛋白的影响,导致抗体与变构位点/表位结合,从而对其功能动力学产生影响。这些效应包括:活性/非活性状态下构象的调节、活性的激活/抑制、与配偶体(配体、受体、共受体)的结合的增强/抑制,包括二聚化、靶标的内化,甚至靶标的拆卸。
1. 变构和抗体
作为一种无所不在的机制,变构调节蛋白质功能动态。靶向变构位点会导致蛋白质构象动力学的扰动,从而提供了另一种调节分子功能的方法。认识到需要探索新的范例来克服耐药性并解决靶标空间限制,变构调节正在作为一种有吸引力的方式。虽然小分子传统上被报道为变构调节剂,但最近才出现肽,抗体可能具有更明显的优势。抗体是对治疗产生巨大影响的大分子,其中 达160+多种抗体已获得全球卫生当局批准用于各个治疗领域。与其他药物相比,抗体由于其较大的结合位点而呈现出更高的选择性。它们的溶解度使它们适合靶向膜结合蛋白和可溶性蛋白。此外,它们的半衰期更长,可以介导靶标效应器功能。
2. 变构抗体:新型成药途径对变构抗体的探索开辟了药物发现和治疗开发的新领域。通过靶向变构位点,这些抗体提供了调节蛋白质功能的创新机制,推进了各种疾病的治疗。
欧洲药品管理局 (EMA) 和/或 FDA 批准的治疗性抗体开发的关键里程碑改变了免疫学和肿瘤学领域对变构机制的理解(图 1)。
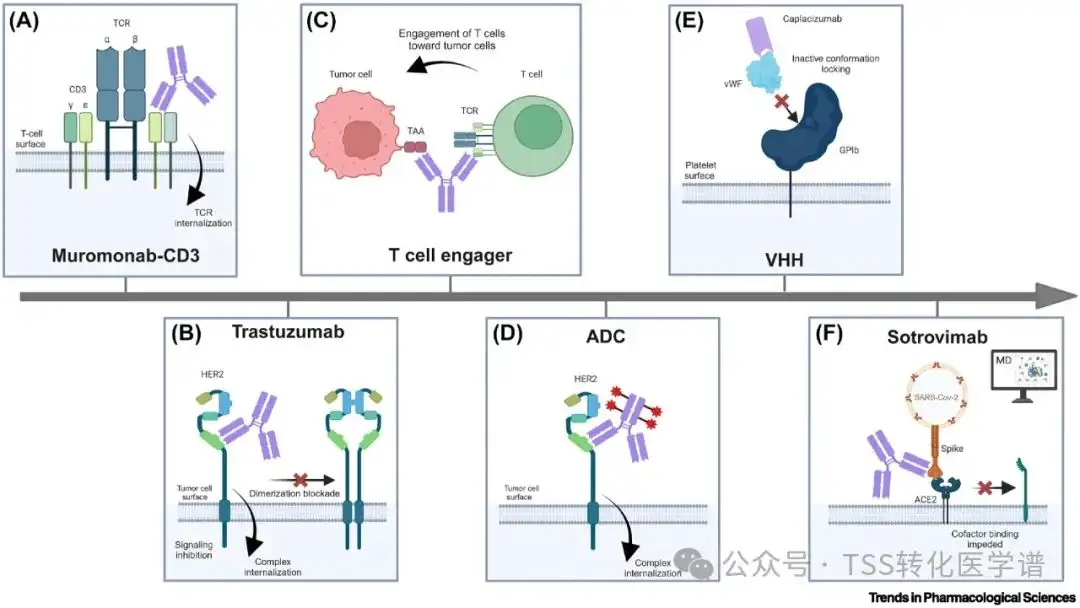
图 1.变构抗体开发的关键里程碑。
第一个批准的抗体,muromonab-CD3 (OKT3),于 1986 年推出。它针对 CD3 的 epsilon 结构,CD3 是 T 细胞表面 T 细胞受体 (TCR) 的一部分。CD3 并不参与 TCR 介导的抗原识别,而是参与信号转导。此外,最近的生化研究表明,muromonab-CD3不会与 CD3 抑制性配体竞争。相反,晶体研究揭示了 muromonab-CD3 与 CD3 构象表位的结合。它通过抗体-受体复合物的结合和随后的内化来防止以变构方式识别抗原(图1)。通过内化选择性去除 TCR 会抑制 T 细胞的细胞毒功能并促进非免疫功能的 T 细胞状态。muromonab-CD3 被批准用于预防器官排斥十年后,抗体开始被批准用于肿瘤学应用。HER2 是一种跨膜受体酪氨酸激酶 (RTK),通常在癌细胞中过度表达,有助于生长和增殖。尽管尚未鉴定出 HER2 的配体,但基于其与同一家族其他受体的相似性,通常推断其胞外结合位点对应于结构域 I 和 III 之间的裂口。已经开发出针对 HER2 的抗体,包括曲妥珠单抗 (Herceptin) 和帕妥珠单抗 (Perjeta)。结构数据揭示了曲妥珠单抗与结构域 IV 的结合,而帕妥珠单抗则靶向二聚化界面(结构域 II)。基于细胞的检测强调,HER2 靶向抗体会对 HER2 二聚化和随后的信号传导产生负面影响,并促进抗体-受体复合物的内化(图 1 )。这些抑制性抗体可被称为变构抗体,因为它们对 HER2 具有非配体竞争性抑制作用。 2010 年代标志着一种称为双特异性的新型抗体形式的首次亮相,因为它们可以结合两个不同的靶标。 大多数双特异性抗体被归类为T 细胞接合剂。它们可以同时结合 T 细胞上 TCR 的 CD3 部分和癌细胞上的肿瘤相关抗原 (TAA)。双特异性抗体将 T 细胞导向肿瘤细胞。临床前模型表明,这些双特异性抗体起到条件激动剂的作用,T 细胞激活依赖于同时结合 CD3 和 TAA。T 细胞通过独立于 TCR 抗原结合结构域的机制被激活,依赖于与 TCR 变构位点 CD3 的结合(图 1)。这种双特异性形式不会导致受体内化,但可以介导激活信号传导。一个突出的例子是重磅炸弹 epcoritamab (Epkinly),它靶向 T 细胞上的 CD3 和 B 细胞上的 CD20,并被批准用于治疗 B 细胞恶性肿瘤。在2020年前些时候,抗体药物偶联物(ADC)形式的新时代出现了。ADC 是一类新型抗体疗法,带有细胞毒性有效负载。 它们以快速内化的膜结合蛋白为目标,允许有毒有效负载在细胞内释放,最终导致表达靶标的细胞被消除。HER2 靶向 ADC 基于曲妥珠单抗,通过变构作用机制发挥作用。如前所述,曲妥珠单抗与 HER2 的变构位点结合,促进抗体-受体复合物的内化(图 1)。因此,基于曲妥珠单抗的 ADC 已被开发并获得批准,例如曲妥珠单抗 deruxtecan (Enhertu),用于治疗表达 HER2 的某些类型的肿瘤。 基于骆驼抗体的小型可变结构域,称为 VHH(重链可变重结构域)的新模式已得到进一步批准。第一种基于 VHH 的治疗剂caplacizumab (Cablivi)可结合 vWF 因子,这是一种促进血小板粘附的血液糖蛋白。 与 vWF 相关的自身免疫性血液疾病会导致血栓形成。结构研究表明,caplacizumab 通过与不同于血小板受体糖蛋白 Ib 的位点结合,稳定了 vWF 对血小板粘附的非活性构象,从而防止了危及生命的血栓形成(图 1)。 值得注意的是,sotrovimab (Xevudy) 靶向受体结合结构域,且不与受体 (ACE2) 结合位点重叠(图 1)。这种近距离破坏了附着后的构象变化,从而中和了COVID-19感染。大量的计算工作,特别是分子动力学 (MD)研究表明,strovimab 通过与已知的变构位点结合,在刺突蛋白内诱导变构扰动。此外,sotrovimab 与对突变不太敏感的表位结合,有助于中和其他 SARS-CoV-2 刺突突变蛋白。这些研究代表了全球首次将计算和实验方法结合起来,以快速发现、开发和表征中和变构抗体。最近的实验和计算方法阐明了探索性靶点的变构作用机制,这些靶点被认为是抗体不可成药的,从而揭示了新的成药途径。
GPCR和 LGIC 是两个最常见的药物靶点。然而,尽管付出了巨大的努力,但很少有抗体能够靶向这些膜嵌入的蛋白质类别。GPCR 构成了药物治疗的主要靶点,大约三分之一的批准药物以它们为靶标。然而,这些药物中只有三种是抗体。这种未满足的缺口是由 GPCR 的小且可接近的细胞外结构域引起的,GPCR 也是一种特别难以表达的蛋白质类别。Scholler 等报告了一种基于 VHH 的 GPCR 正变构调节剂:mGlu2 的发现。mGlu 受体家族是一种C 类 GPCR,由一种称为代谢型谷氨酸的神经递质激活。这些受体是治疗脑相关疾病的有希望的靶标,VHH 可能是治疗这些疾病的替代药物。结构研究揭示了 mGlu2 靶向 VHH 与 Venus Flytrap (VFT) 叶的结合以及受体活性形式的整体稳定(图 2),从而在体外和体内表现出激动活性。这种结构不同于 mGlu 的非活性形式(图 2)。此外,VFT 结构域还拥有一个重要的 mGlu 受体变构位点。还报道了针对 mGlu4 的其他变构抗体,mGlu5 和 mGlu7。有趣的是,靶向 mGlu7 的抗体通过促进活性受体复合物的内化,与正构和变构激动剂表现出负协同作用。
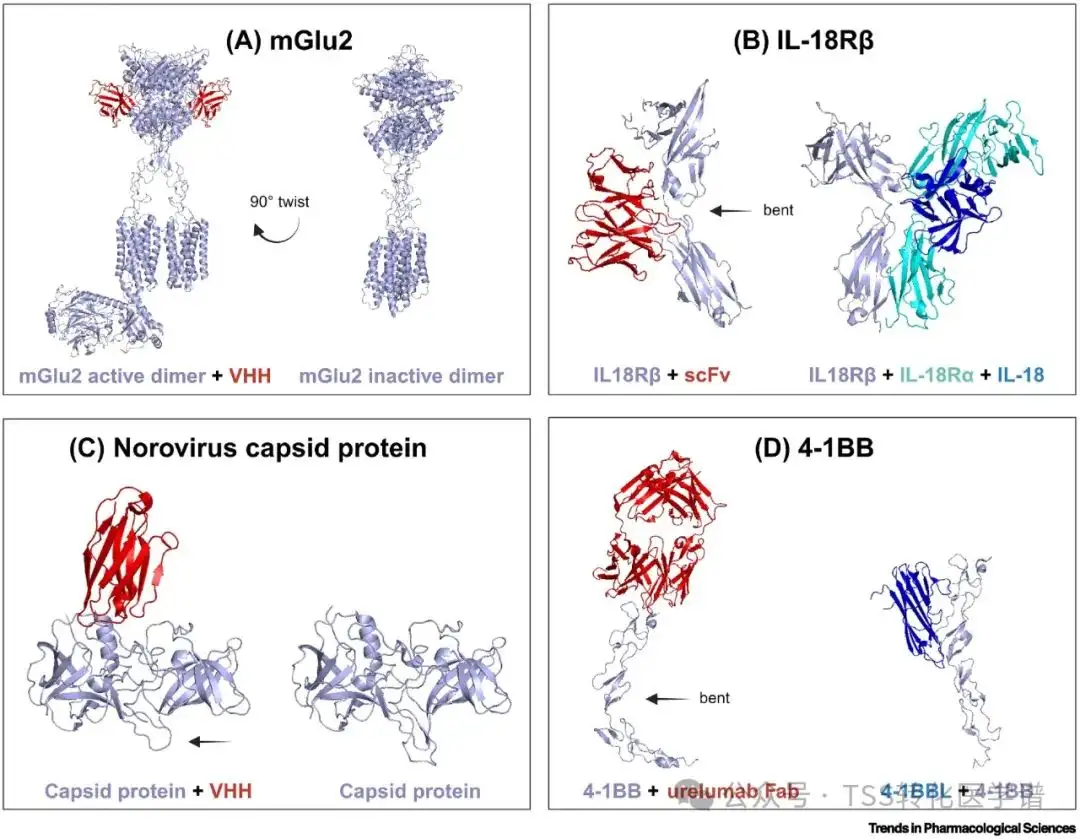
图 2.抗体与靶蛋白变构位点结合引起的构象变化。
此外,最近的一份报告描述了一种抑制钙敏感受体(CaSR)的变构抗体。CaSR 是另一种C 类 GPCR,可感应体内钙浓度。该受体的激活突变会导致低钙血症。有趣的是,冷冻电子显微镜 (cryo-EM) 证明与也位于受体 VFT 结构域上的表位结合。VHH 结合并稳定 CaSR 的非活性状态,从而抑制其信号传导。此外,Cui 等证明了这种VHH 增强了其他 CaSR 拮抗剂的抑制作用,特别是包括小分子负变构调节剂。LGIC 是调节细胞内外离子通量的跨膜蛋白。它们构成了第二大治疗靶标类别。乙酰胆碱受体(AChR)是变构背景下最广泛表征的受体之一,尽管事实上仅报道了小分子变构调节剂。最近,Corringer 的研究组发现了一种 VHH,它可以作为 α7-nAChR 的正变构调节剂[]。他们的冷冻电镜结构揭示了这种 VHH 稳定了激动剂结合构象并增强了乙酰胆碱引发的电流 [10.1038/s41467-023-41734-4 ]。这些研究为利用 VHH 靶向 LGIC 的新方法提供了希望。LGIC 变构调节的另一个引人注目的例子是针对N-甲基-d-天冬氨酸受体(NMDA)的抗体:GluN2B。该抗体专门稳定并锁定 GluN1-GluN2B 复合体的非活性构象,从而消除其功能。通过 MD 模拟,Tajima 和同事强调了抗体结合时的长程变构通讯,将受体的数量转变为非活性构象状态[ 10.1038/s41467-022-28559-3]。这项研究强调了使用计算方法验证变构通信的重要性,以全面了解抗体如何变构发挥作用。总之,由于变构扰动,GPCR 和 LGIC 在活性和非活性状态之间经历了重大构象变化。这种动态性质使它们特别适合表现出变构作用模式的抗体的靶标。
作用于变构位点的抗体可以调节蛋白质的信号传导,该信号传导可能在多种疾病中失调。治疗退行性疾病、癌症和自身免疫性疾病的突破性发现已经出现,凸显了调节这些靶蛋白的新药理学。富含亮氨酸重复激酶 2 (LRRK2) 是一种大型多结构域蛋白激酶,在各种细胞过程中发挥着至关重要的作用;这种蛋白质的突变是遗传性帕金森病的主要原因。LRRK2 治疗的主要重点是竞争性抑制剂,该抑制剂对 LRKK2 的特异性较差。Singh 及其同事旨在发现针对 LRRK2 各个部分的 VHH。他们将免疫和筛选结合起来,使抗体发现过程偏向表现出变构作用模式的抗体。有趣的是,一组变构 VHH 被鉴定出来。通过蛋白质交联,这些结合残基被映射到活性位点之外,证明 VHH 稳定了 LRRK2 的非活性构象。这些发现凸显了利用变构位点开发新的 LRRK2 靶向药物来调节其活性的潜力[10.1073/pnas.2112712119]。最近,一项综合研究详细介绍了首次鉴定出靶向并抑制胞外域磷酸酶/磷酸二酯酶-1 (ENPP1) 的 VHH,ENPP1 是一种在癌症中过度表达的免疫检查点。Solomon 及其同事获得了冷冻电镜结构,以确认抗体与位于水解酶活性位点附近的神秘变构位点的结合。除了诱变研究之外,他们还确定了调节 ENPP1 底物特异性抑制的关键独特结合残基。该 VHH 是第一个报道的 ENPP1生物抑制剂,揭示了变构抑制的新机制。这一突破性发现促进了各种抗体形式的设计和探索,包括针对另一个免疫检查点 PD-L1 的双特异性抗体。这种形式表现出强大的细胞活性,与小分子相比表现出更大的特异性。 白细胞介素受体 (IL-R) 在细胞通讯中发挥着至关重要的作用,其失调与炎症性疾病和自身免疫性疾病有关。因此,阻断白细胞介素信号传导可能会带来显着的治疗益处。Liu 及其同事报道了一种针对IL-18Rβ的合成抗体的开发。作者获得了该复合物的晶体结构,揭示了该抗体与 IL-18Rβ 的一个位点结合,该位点与 IL-18 结合位点不同。抗体结合引起IL-18Rβ的显着构象变化,从而修饰了IL-18和IL-18Rα的结合位点(图2),从而阻碍了三元复合物IL-18/IL-18Rα/IL-18Rβ的形成以及随后的形成。信令[10.1016/j.jmb.2020.01.012]。
传染病是由病毒、细菌、真菌和寄生虫引起的。靶向病毒或细菌蛋白的变构位点具有显着的优势,因为这些位点往往对突变不太敏感。例如,诺如病毒是全球胃肠炎流行的主要原因。这些病毒可以在其衣壳蛋白中积累大量突变,尽管付出了巨大的努力,但尚未批准基于抗体的治疗方法。有趣的是,中和表位已在附着位点之外被识别,并且一组 VHH 已被表征。Salmen 及其同事获得了 VHH 的晶体结构,该结构可识别大多数衣壳蛋白变体,揭示了与远离配体结合位点的表位的结合(图 2 )。生物物理测定和冷冻电镜表明,VHH 结合改变了衣壳的结构动力学,最终导致分解[10.1038/s41467-023-42146-0 ]。这些发现为靶向病毒的变构活性区域提供了独特的机会,可能阻止感染并促进病毒颗粒的破坏。金黄色葡萄球菌等细菌也可能引起感染,这种细菌会释放强力毒素葡萄球菌肠毒素 B (SEB)。Fan 和同事最近从患者身上鉴定出一种抗体,该抗体针对 SEB 上的线性保守表位。它们的晶体结构揭示了远离 SEB 受体(MHC-II 和 TCR)的结合位点。生化和基于细胞的测定表明,该抗体会对 MHC-II 和 TCR 与 SEB 的结合产生负面影响,干扰三元复合物的形成,表明变构抑制[10.1080/21645515.2024.2360338]。该抗体在体外和体内中和了 SEB 诱导的毒性和细菌感染,开辟了一种对抗细菌感染的新策略。
激活信号传导的激动剂抗体已成为恢复或增强细胞信号传导的有前景的生物制剂。许多激动剂抗体靶向 TNFRSF 中的共刺激受体,TNFRSF 是细胞因子受体的超家族。有趣的是,已经发现了作用于这些受体变构位点的激动剂抗体。在这些受体中,4-1BB,也称为CD137,是用于癌症免疫治疗的 T 细胞的一个有前景的靶标。Urelumab是一种靶向 4-1BB 的激动剂抗体,与 4-1BB 配体 (4-1BBL) 位点远端的位点结合。它会引起 4-1BB 内的构象变化,从而改变其空间方向,从而导致外观更加弯曲(图 2 )。此外,如共焦成像所示,该抗体可促进受体聚集。与与 4-1BBL 竞争的其他第一代抗 4-1BB 抗体相比,Urelumab 可诱导更强的 4-1BB 激活 [10.1038/s41467-018-07136-7 ]。除了激动剂作用外,变构抗体还可以自然识别配体,从而提供增强靶向方法的可能性。OX40 是 TNFRSF 的另一个成员,据报道也受到抗体的变构调节。变构抗 OX40 抗体的基本原理是增加与 OX40 激活相关的功效,而不损害其天然配体 OX40L 的识别。共晶结构表明,该抗体与 OX40 的另一面(如 OX40L)结合在近端表位上[10.1007/s11684-023-0996-8]。在临床前模型中,据报道该抗体可促进 IL-2 分泌,从而增加 T 细胞增殖。作用于变构位点的抗体可以充当激动剂抗体,激活 TNFRSF 中共受体的信号传导。这种激活不仅由靶标表位决定,而且还可以通过同种型选择来增强。值得注意的是,IgG2 形式的灵活性不如其他 IgG,这表明抗体与其同源靶蛋白之间存在额外的通信。2.6 抗体铰链区对激动性的重要性
Yang 及其同事讨论了不同的 IgG 亚类尽管具有相同的可变区,但由于其恒定区的变化而表现出不同的功能特性。这些差异会影响抗原结合亲和力、特异性和效应器功能。铰链是抗体的核心部分,提供灵活性并促进抗体结构内的通讯。与 IgG1 形式相比,IgG2 形式在其铰链区具有额外的二硫键,这增加了其刚性。IgG2 赋予 TNFRSF 中多个靶标的激动特性。当修改针对TNFRSF的另一个成员CD40的抗体同种型时,可以观察到功能的转换,特别是激动剂和拮抗剂活性之间的翻转。拮抗性抗CD40抗体可以通过采用IgG2形式修饰为超级激动剂,在体外研究中其效力超过其他激动剂抗体。因此,铰链灵活性和激动性之间的反比关系正在出现(图3)。这些发现构成了范式转变,其中靶向表位和抗体形式对于活性发挥着同等的作用。这使得理解抗体的结构-活性关系变得极其困难,并凸显了设计完整抗体结构的挑战性。
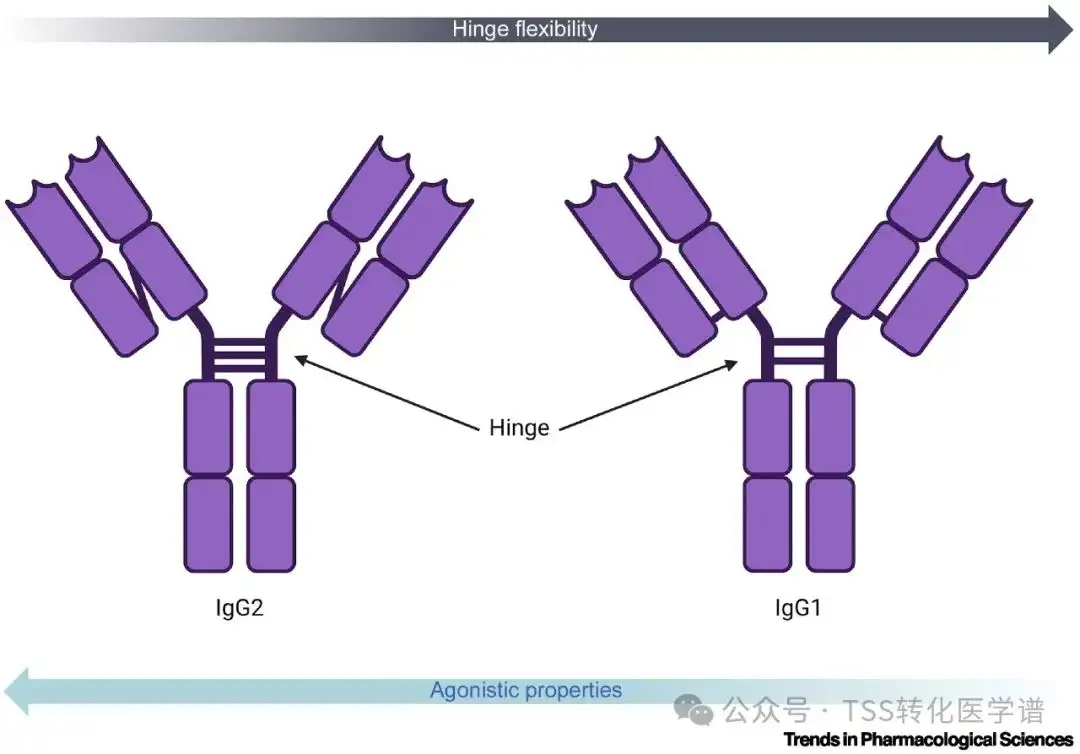
图3. 铰链灵活性和对抗特性之间的反比关系。
通过变构机制成功调节靶蛋白正在为下一代抗体形式的工程化铺平道路。除了 T 细胞结合剂之外,双特异性抗体还可以充当自然杀伤 (NK) 细胞结合剂。这些分子靶向 NK 细胞上的受体和癌细胞上的 TAA。如针对 NKp30 和 EGFR(另一种与 HER2 结构相似的 RTK)变构位点的功能性双特异性抗体形式,证明了 NK 细胞的参与并增强了肿瘤活性。与 T 细胞类似,NK 细胞可以独立于配体结合而被重定向和激活。一种新形式的条件激活性抗体,其活性受环境调节以发挥其潜力,可以增强抗体的特异性。如由基于钙调蛋白接头的可切换抗体片段组成。钙调蛋白构象转换促使抗体片段内的构象变化影响抗原结合,使这种形式成为可以进行变构调节的超组装复合体。
3. 变构工具抗体:超越治疗应用对变构抗体的探索为未来的治疗发展带来了巨大的希望,有可能带来更有效、更有针对性的治疗。这种变构抗体是药物发现领域的突破性进展,提供了调节蛋白质功能的独特机制。虽然它们的治疗应用有据可查,但这些抗体也可以在更广泛的药物发现背景下作为宝贵的工具。
蛋白质构象的稳定是药物化学中的一项关键技术,对通过高通量筛选(HTS)发现小分子做出了重大贡献。最近,基因泰克的研究人员报告发现了能够结合并稳定 KRAS 特殊构象的抗体,类似于已批准的抗 KRAS 小分子诱导的构象。70]。KRAS 是一种在癌症中失调的细胞内蛋白。虽然传统上治疗抗体无法接近,但它仍然是小分子的主要目标。长期以来,KRAS 被认为是不可成药的,直到构象口袋的识别和利用。通过捕获这种独特的构象,这些抗体可促进 HTS 并提高新型治疗化合物的发现率。同样,ConfoTherapeutics 开发了其专有的 高通量筛选 ConfoBodies 平台,该平台利用构象稳定的 VHH 来支持靶向 GPCR 的小分子的 HTS。这些 ConfoBodies 选择性地稳定 GPCR 的活性或非活性构象异构体。
构象变化使研究人员能够表征各种靶蛋白的无序区域。历史上,蛋白质构象的稳定是通过与片段抗原结合 (Fab) 共结晶来实现的。如今,VHH 等较小的抗体片段在 GPCR 等复杂蛋白质的研究中发挥着至关重要的作用。 并且对于获得高分辨率结构至关重要,特别是对于捕获独特的构象。此外,还报道了一种针对 TNF 的抗体,该抗体与 TNF 的变构位点结合,有助于阐明 TNF-TNFR1 复合物的结构,从而深入了解其动态。总之,变构抗体不仅是有价值的治疗化合物,而且是药物发现的强大工具。它们稳定特定蛋白质构象的能力增强了 HTS 并促进结构研究。它们在推进药物化学和结构生物学方面的作用将扩大到更好地理解化合物的作用机制。
4. 设计变构抗体的未来方向
发现变构抗体的主要挑战之一是它们的鉴定,这主要是由于偶然性,尽管一些团体提出了有利于变构抗体的有偏倚的实验方法。然而,计算结构生物学的最新进展显着增强了我们识别相关变构位点的能力。这些计算方法可以与从头抗体设计的初始步骤相结合,为开发变构抗体提供更系统的方法。
有多种计算方法可用于识别变构位点。然而,传统方法主要侧重于识别小分子可以结合的口袋。蛋白质-蛋白质相互作用,例如抗体-抗原界面,由于其动态性质和大尺寸,需要更通用的方法。除了寻找口袋之外,更通用的方法是识别靶标蛋白中的变构网络以及关键区域之间的相应通信。这种理论理解源于蛋白质变构通讯的进化保守性,尽管它们的结构和序列存在可变性。例如,通过评估靶标蛋白不同区域之间响应结合事件和突变的能量学和因果关系,基于结构的变构统计模型(SBSMMA),提供了变构表位鉴定的框架。纳入AlloSigMA网络服务器,SBSMMA 允许通过靶蛋白正位点的扰动(即反向扰动方法)来检测变构活性区域,与机器学习(ML)方法相结合,有可能实现强大的预测能力。
对蛋白质调控的理解与蛋白质结构预测的最新突破相结合,为设计针对给定变构位点的抗体提供了绝佳的机会。人工智能 (AI)和计算结构生物学的最新进展表明,可以利用 ML 算法从头生成针对结合亲和力和特异性进行优化的抗体序列。更好地理解蛋白质的变构通讯也将有利于抗体的设计,因为抗体本身是高度动态的。抗体结构内的这些通信提供了对抗体功能的新理解,应全面考虑抗体功能,而不仅仅是关注其互补表位。总而言之,这些先进的计算方法预计将使研究人员能够有效地定制针对特定变构位点的抗体,从而有可能改善治疗结果并减少脱靶效应。
