产品中心
技术交流

扫描二维码
FDA批准的第7款CART
原创:of studies 来源:细胞基因研究圈
2024年11月8日,位于伦敦的生物制药企业Autolus Therapeutics plc宣布其研发的Aucatzyl(obecabtagene autoleucel)——一种靶向CD19的CAR-T细胞疗法,已获得美国食品药品监督管理局(FDA)的批准,正式上市。该疗法主要用于治疗复发或难治性前体B细胞急性淋巴细胞白血病(r/r B-ALL)成人患者。Aucatzyl作为FDA批准的第7款CAR-T产品,其价格也达到了前所未有的高度,定价为52.5万美元。
FDA批准的7款CAR-T
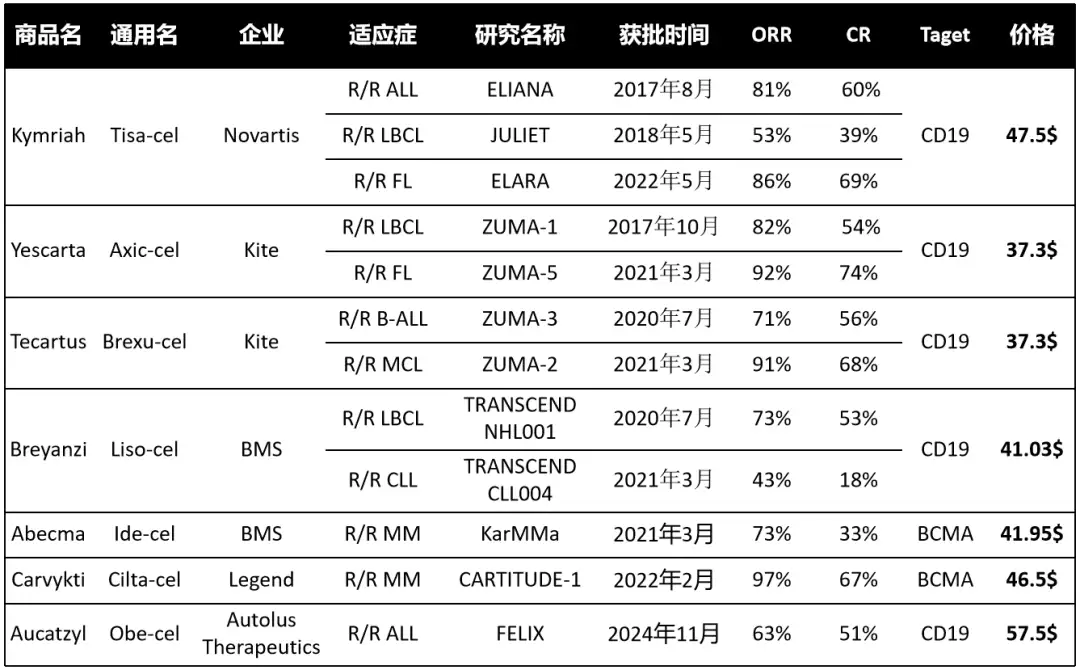
FELIX的Ib/II期临床结果
Autolus在2024年美国临床肿瘤学会(ASCO)大会上公布了FELIX研究(NCT04404660)的Ib/II期结果:上表中的数据来源于该研究的第3部分。

截至2022年9月9日,对首批50名接受Obe-cel治疗的Cohort A患者进行了中期分析。患者的中位年龄为50岁,其中22%患有Ph+ B-ALL,中位既往治疗线数为2,42%的患者既往接受过移植。在筛查时,患者的中位骨髓原始细胞比例为55%,26%的患者存在髓外疾病。
CAR-T细胞扩增的几何平均峰值为126,147.6 copies/μg DNA,且大多数应答者的CAR-T细胞持久性得以维持。
根据中心评估,CR/CRi(完全缓解/完全缓解伴不完全血液学恢复)的比例达到了70%。
截至2022年9月9日,共有92名患者接受了Obe-cel治疗并完成了安全性评估。其中,63%的患者出现了任何级别的细胞因子释放综合征(CRS),3%为≥3级,中位发生时间为输注后9天,持续时间为5天;23%的患者出现了任何级别的免疫效应细胞相关神经毒性综合征(ICANS),8%为≥3级,中位发生时间为输注后15天,持续时间为8天。其他常见的≥3级不良事件包括发热性中性粒细胞减少症(25%)和贫血(20%)。
FELIX研究的中期分析表明,Obe-cel在成人复发或难治性前体B细胞急性淋巴细胞白血病(r/r B-ALL)患者中具有良好的安全性,即使在疾病负担较高的患者中,3级以上CRS和/或ICANS的发生率也较低。此外,Obe-cel在大多数应答者中展现出较高的CR/CRi率以及持续的CAR-T细胞持久性(来源1)。
严重CRS和ICANS是CAR-T疗法领域亟待解决的重要挑战之一。Aucatzyl这一产品正是为了克服传统CD19 CAR-T细胞疗法在安全性和疗效方面的局限性而研发的。
那Aucatzyl使用了什么方法克服目前传统CD19-CART的局限性?
Aucatzyl是FDA批准的首款无需REMS计划(风险评估缓解策略)的CAR-T疗法。相较于现有疗法,Aucatzyl针对现有痛点进行了优化,具备更精准的靶向设计。其独特之处在于采用了快速靶标结合解离设计,使得CAR与CD19结合后能够迅速解离,从而避免T细胞过度激活,降低T细胞耗竭的风险,增强CAR-T疗法的持久性。理论上,Aucatzyl在不降低疗效的前提下,可显著降低细胞因子释放综合征等严重不良反应的风险,使更多患者能够安全、有效地接受治疗。
除了快速靶标结合解离设计外,Aucatzyl与传统CAR-T产品还存在以下差异:
输注方式不同
与另外6款已上市的CAR-T产品采用单次回输的方式不同,Aucatzyl在清淋化疗后,采用分次剂量输注的方式给药。
Aucatzyl的总推荐剂量为4.1×10⁸个CAR-T细胞,以3至5个冻存袋的形式提供。
这些冻存袋采用三种颜色编码的袋子配置,具体为:蓝色袋(1×10⁷个CAR-T细胞)、橙色袋(1×10⁸个CAR-T细胞)和红色袋(3×10⁸个CAR-T细胞),用于实现分剂量给药。

那这3种剂量按照什么顺序回输呢?
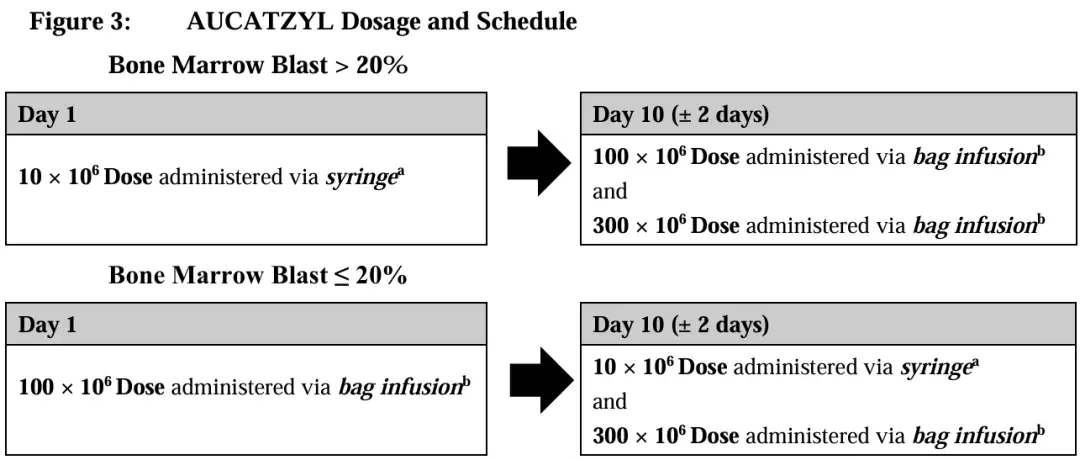
根据清淋化疗前骨髓中原始细胞的比例(即肿瘤负荷的高低),Aucatzyl的剂量顺序有所不同:
若原始细胞占比>20%,则在第1天输注蓝色袋(1×10⁷个CAR-T细胞),在第10天输注橙色袋(1×10⁸个CAR-T细胞)和红色袋(3×10⁸个CAR-T细胞);
若原始细胞占比≤20%,则在第1天输注橙色袋(1×10⁸个CAR-T细胞),在第10天输注蓝色袋(1×10⁷个CAR-T细胞)和红色袋(3×10⁸个CAR-T细胞)。
预处理方案不同:增加了氟达拉滨剂量
清淋预处理方案在CAR-T治疗中存在差异,大多数方案采用3天的预处理,而Aucatzyl的方案有所不同。Aucatzyl的清淋预处理方案减少了环磷酰胺的使用天数,但增加了氟达拉滨的使用天数,且总剂量相对较高。
如之前提到的关于确定CD4/CD8比例的CAR-T治疗非霍奇金淋巴瘤的研究,环磷酰胺和氟达拉滨的联合预处理方案与更高的CAR-T细胞扩增和更长的持续时间相关。对于大B细胞淋巴瘤(LBCL)患者,单独使用环磷酰胺的CD19 CAR-T疗法的完全缓解(CR)率低于10%,而环磷酰胺与氟达拉滨联合使用时,CR率可以提高到50%。
氟达拉滨有助于清除淋巴细胞,并提高IL-15水平,从而减弱机体对CAR-T细胞的排异反应。
Aucatzyl增加氟达拉滨的总剂量,可能正是基于这些原因。
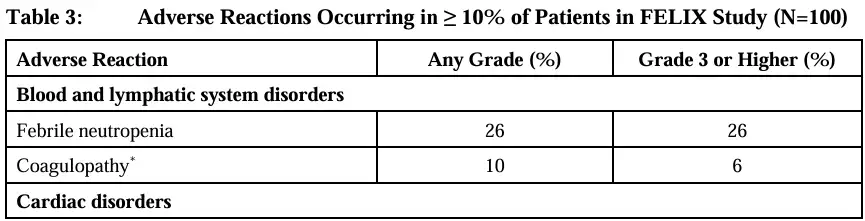
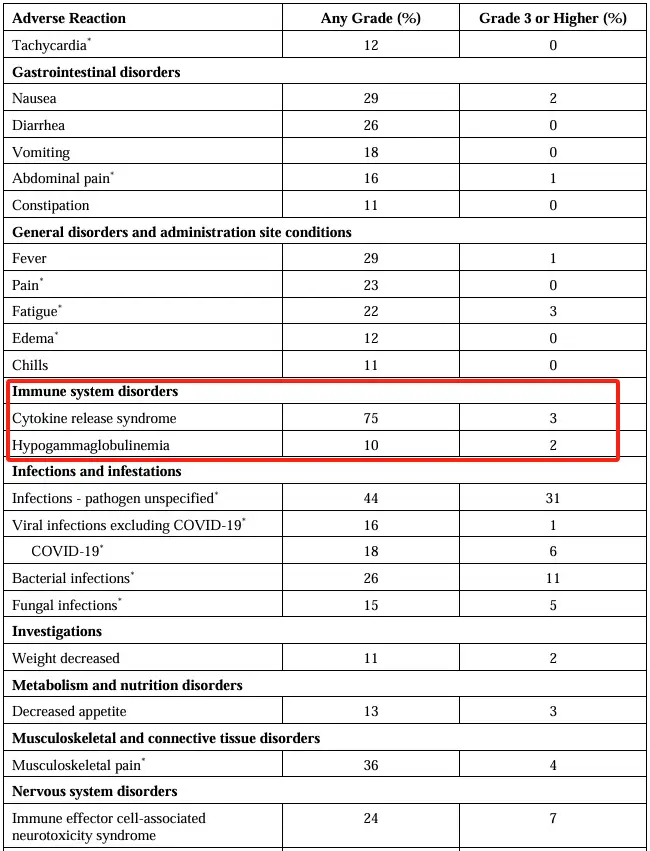
不良事件发生汇总
不同给药方案ddPCR检测外周血转基因水平的药代动力学参数
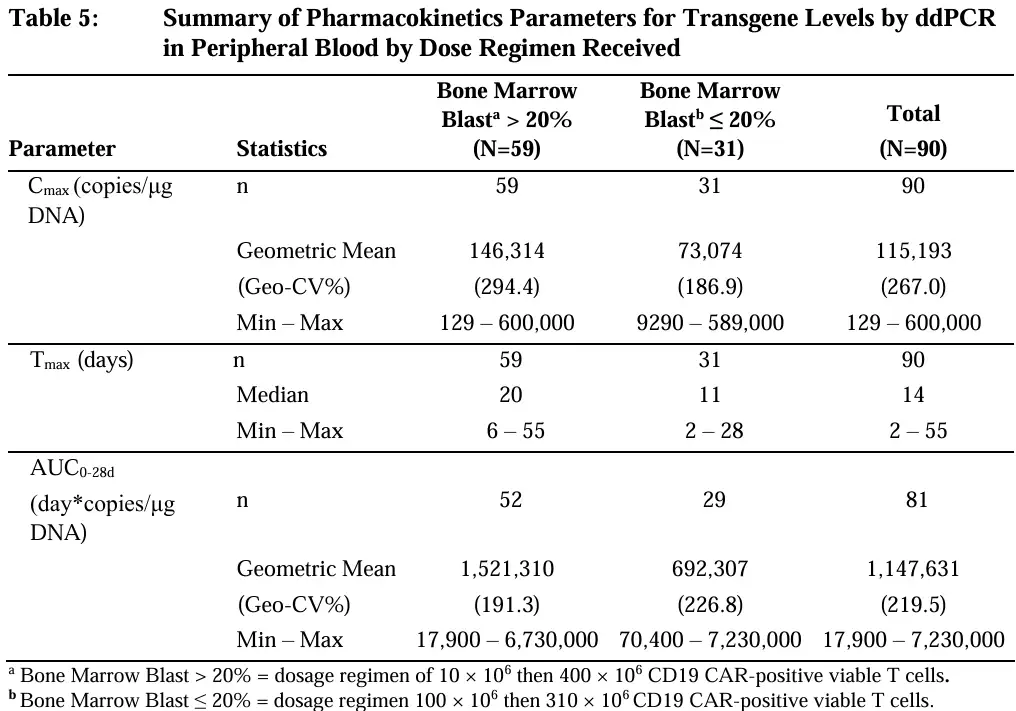
在对Aucatzyl治疗效果的评估中,75.9%(22/29)的患者在最后一次实验室评估时显示出持续的CAR-T细胞持久性,其中观察到的最长持久性达到了36.5个月。
在CAR-T细胞扩增方面,接受首次分裂剂量为1×10⁷个细胞(原幼占比>20%)的患者,相较于接受首次分裂剂量为1×10⁸个细胞(原幼占比≤20%)的患者,展现出更高的CAR-T细胞扩增水平(以Cmax和AUC₀₋₂₈ᵈ为指标)。此外,CAR-T细胞的持久性并未受到肿瘤负荷的影响。
小结
Aucatzyl的细胞制备、冻存以及给药流程确实更为复杂,这也在一定程度上解释了其高昂的价格。然而,从现有的数据来看,Aucatzyl显著降低了严重细胞因子释放综合征(CRS)的发生率,为患者带来了新的治疗选择。
这种创新的治疗方案在提高安全性和疗效方面的优势,使其在CAR-T细胞疗法领域具有重要的临床价值。