产品中心
技术交流

扫描二维码
癌症疫苗:平台介绍及进展
原创:彪彪 来源:生物制品圈

癌症疫苗的研发始于19世纪末,William B. Coley观察到细菌毒素可诱导肿瘤消退,首次揭示了免疫系统与癌症的关系。20世纪80年代,BCG疫苗被用于膀胱癌治疗,成为首个获批的治疗性癌症疫苗。2010年,Sipuleucel-T的上市标志着个性化免疫治疗的突破。近年来,基因工程技术的进步(尤其是mRNA疫苗)在胶质母细胞瘤和黑色素瘤中展现出显著潜力。例如,靶向EB病毒的mRNA疫苗WGc-043和针对黑色素瘤的mRNA-4157已在临床试验中取得积极成果。然而,肿瘤抗原异质性、免疫抑制微环境及递送效率仍是主要挑战。
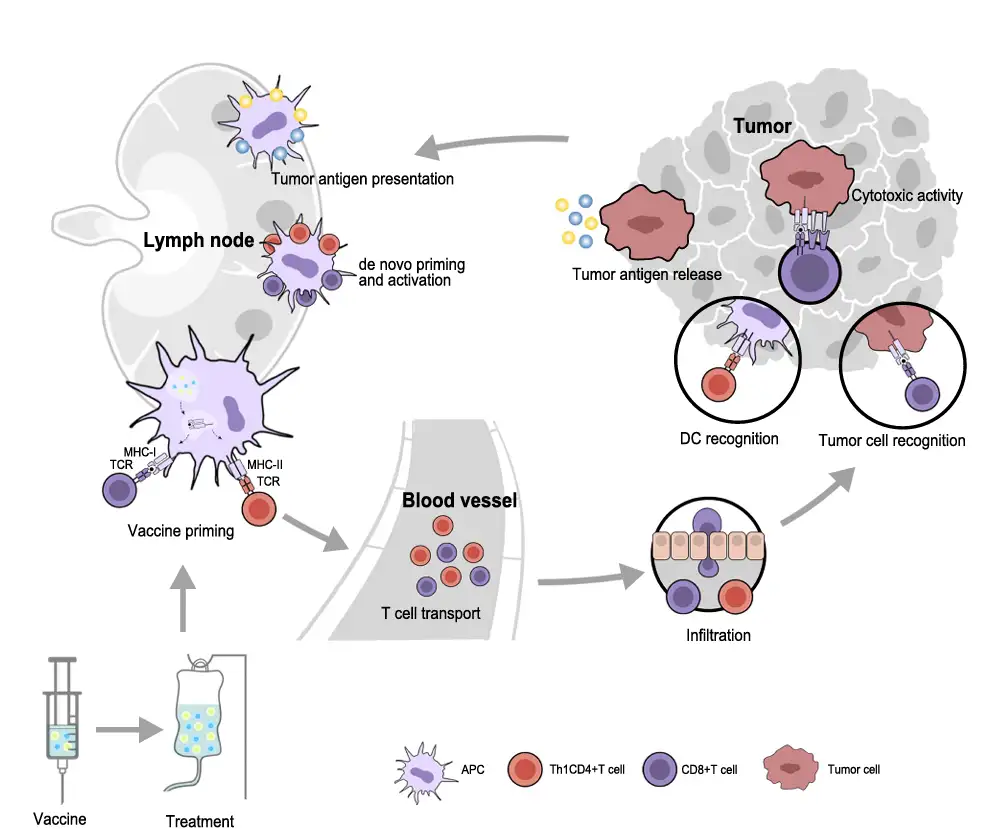
图1 治疗性癌症疫苗的免疫反应机制
描述:疫苗通过递送肿瘤抗原至DC,激活CTL和CD4+ Th1细胞,诱导肿瘤细胞杀伤。APC(抗原呈递细胞)通过MHC分子呈递抗原,触发T细胞受体(TCR)信号通路。
HPV疫苗:覆盖HPV 16/18等高危亚型,降低宫颈癌、肛门癌及口咽癌发病率。临床数据显示,接种后宫颈癌前病变发生率下降60%-90%。需与常规细胞学筛查联合应用。
HBV疫苗:通过阻断乙肝病毒感染,降低肝细胞癌风险。全球范围内接种率提升使肝癌发病率显著下降。
治疗性疫苗需满足以下关键特性:
高效抗原递送:优先选择肿瘤特异性新抗原(如EGFRvIII、KRAS突变),避免自身免疫毒性。
克服免疫抑制微环境:TME中的调节性T细胞(Treg)和髓源性抑制细胞(MDSC)可抑制DC功能,需联合佐剂(如TLR激动剂)增强DC活性。
持续免疫记忆:通过激活记忆T细胞,防止肿瘤复发。
TAAs在肿瘤和正常组织中均有表达,如CEA(结直肠癌)、PSA(前列腺癌)和MUC1(乳腺癌)。早期临床试验中,CEA疫苗在结直肠癌患者中诱导免疫应答,但疗效短暂。AFP肽疫苗在肝细胞癌中部分患者实现完全缓解,提示TAAs的潜力与局限性。
TSAs由肿瘤突变产生,如EGFRvIII(胶质母细胞瘤)、RAS突变(胰腺癌)及p53突变(多种实体瘤)。新抗原的筛选依赖于:
全外显子测序(WES)和RNA测序:识别体细胞突变及表达水平。
质谱技术(MS):精确检测免疫肽段,减少预测算法误差。
生物信息学工具:NetMHCpan等算法预测抗原与MHC结合亲和力。
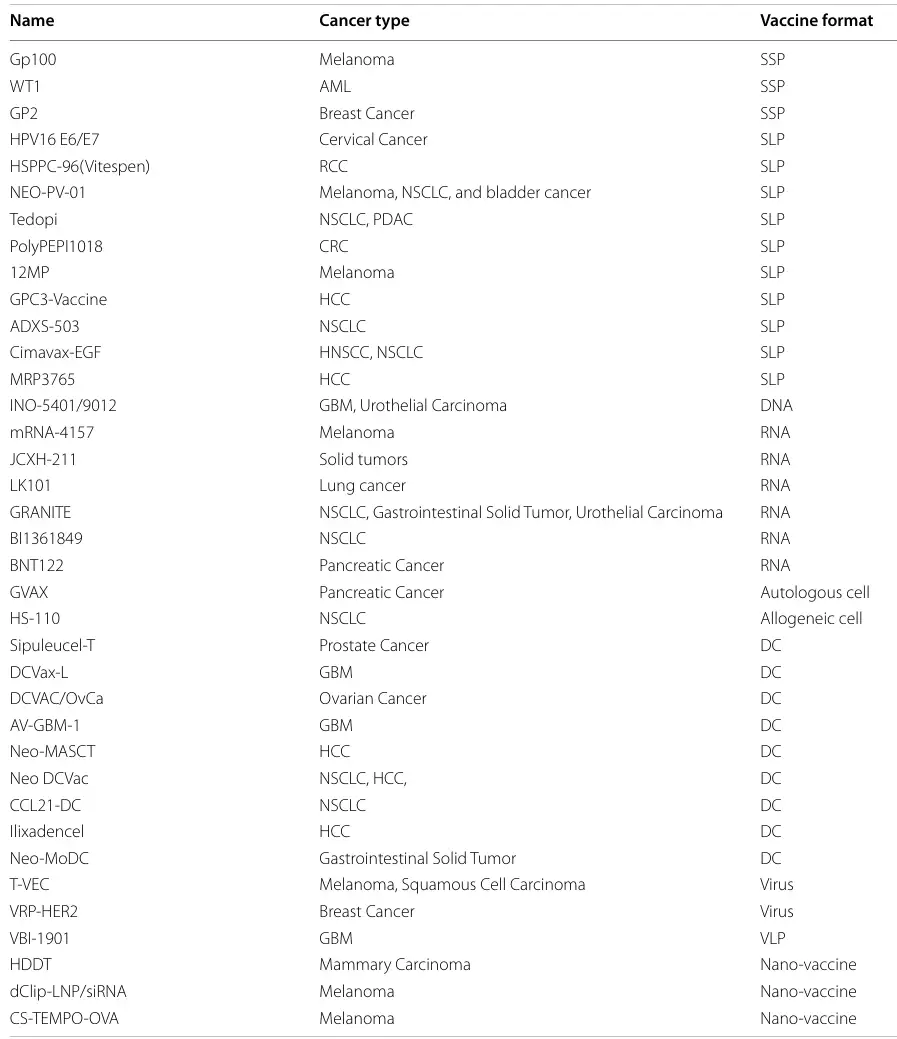
表1 新抗原疫苗临床案例
短肽疫苗(8-15氨基酸):如gp100疫苗联合高剂量IL-2,客观缓解率(ORR)达42%。但需佐剂(如Poly-ICLC)增强免疫原性。
长肽疫苗(20-30氨基酸):如HPV E6/E7长肽疫苗在宫颈癌中耐受性良好,诱导强效T细胞应答。
多价肽疫苗:NEO-PV-01联合PD-1抑制剂在黑色素瘤中ORR达35%,显著优于单药治疗。
DNA疫苗:INO-5401编码hTERT和WT1抗原,联合PD-1抑制剂在胶质瘤中延长生存期。
mRNA疫苗:mRNA-4157联合Pembrolizumab在黑色素瘤III期试验中降低44%复发风险。脂质纳米颗粒(LNP)递送系统提升稳定性,如BNT122在胰腺癌中激活多克隆T细胞。
自体肿瘤细胞疫苗:GVAX通过分泌GM-CSF募集DC,但单药疗效有限。联合化疗或免疫检查点抑制剂可增强响应。
DC疫苗:Sipuleucel-T通过体外负载PAP抗原延长前列腺癌患者生存期(中位OS 25.8 vs 21.7个月)。DCVax-L负载肿瘤裂解物,在胶质瘤中5年生存率提升至13%。
溶瘤病毒:T-VEC(表达GM-CSF)在黑色素瘤中客观缓解率25.2%,中位OS 41.1个月。
病毒样颗粒(VLP):VBI-1901靶向CMV抗原,在复发性胶质瘤中中位OS达12.9个月。
脂质体/介孔二氧化硅:增强抗原递送至淋巴结,激活DC和CTL。如dClip-LNP/siRNA纳米疫苗通过沉默TIM-3增强抗肿瘤免疫。
自组装纳米结构:CS-TEMPO-OVA纳米疫苗联合PD-1抑制剂抑制黑色素瘤转移。

图2 纳米疫苗作用机制
描述:纳米载体共递送抗原和佐剂至淋巴结,促进DC成熟及T细胞活化。
TLR激动剂:
TLR3激动剂(Poly-ICLC)诱导IFN-β和IL-12,增强抗原交叉呈递。
TLR4激动剂(MPL)激活NF-κB通路,促进Th1极化。
细胞因子:IL-12和GM-CSF增强T细胞增殖,但需平衡疗效与毒性(如IL-2引发毛细血管渗漏综合征)。
脂质纳米颗粒(LNP):保护mRNA免受降解,如Moderna的mRNA-5671靶向KRAS突变。
可降解聚合物(PLGA):控释抗原,延长免疫应答。
表2 佐剂分类及代表疫苗

联合疗法
化疗诱导免疫原性细胞死亡,释放肿瘤抗原。
案例:SurVaxM(靶向Survivin)联合替莫唑胺在胶质母细胞瘤中延长无进展生存期(PFS 11.4个月)。
放疗增强肿瘤抗原释放并改变TME。
案例:PSA靶向疫苗联合放疗在前列腺癌中显著提升抗原特异性T细胞数量。
疫苗逆转T细胞耗竭,ICI阻断PD-1/PD-L1通路。
案例:mRNA-4157联合Pembrolizumab在黑色素瘤中ORR达50%,降低复发风险44%。
疫苗增强CAR-T持久性与肿瘤浸润。
案例:CLDN6 mRNA疫苗联合CAR-T在实体瘤中实现33%客观缓解率。
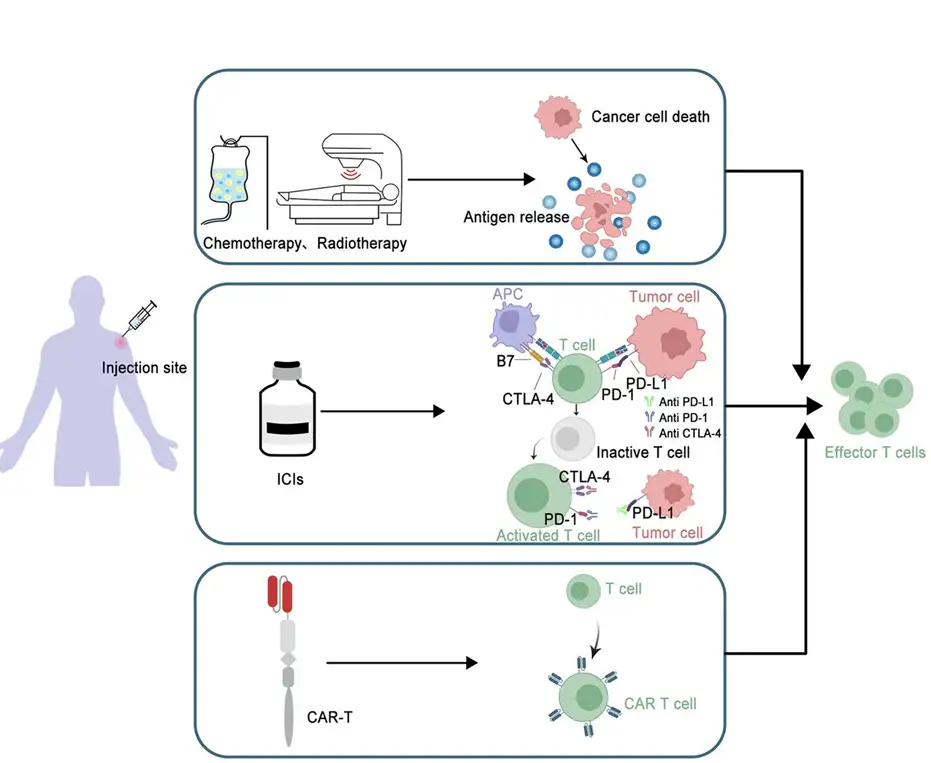
图3 联合疗法机制示意图
描述:疫苗与化疗、放疗、ICI或CAR-T协同,通过多通路激活抗肿瘤免疫。
1.抗原筛选与个性化制备:新抗原预测需结合基因组学与免疫肽组学,成本高且周期长。
动物模型局限性:人源化小鼠难以完全模拟人类免疫系统,需开发类器官或芯片替代模型。
不良反应管理:
常见:注射部位反应、发热、疲劳。
严重:细胞因子释放综合征(CRS)、自身免疫性毒性。
耐药机制:肿瘤抗原丢失或MHC下调可导致免疫逃逸。
癌症疫苗通过多平台创新与联合策略展现出变革性潜力。未来方向包括:
精准新抗原筛选:结合AI优化预测算法,降低成本。
新型递送系统:开发靶向淋巴结或穿透血脑屏障的纳米载体。
克服免疫抑制:联合TME调控剂(如TGF-β抑制剂)或表观遗传药物。
临床转化加速:利用器官芯片替代部分动物试验,缩短研发周期。
随着mRNA技术和个性化医疗的突破,癌症疫苗有望成为“治愈性疗法”的重要组成部分,为实体瘤和血液肿瘤患者带来长期生存希望。