产品中心
技术交流

扫描二维码
干细胞分化的调控网络
来源:干就有未来
干细胞是一类具有自我更新和多向分化能力的细胞,在适宜条件下能够分化成特定谱系细胞群,进而形成不同的组织和器官。因此,干细胞疗法在再生医学领域具有极大的应用前景。干细胞按照来源主要分为胚胎干细胞(embryonic stem cell,ESC)和成体干细胞(adult stem cell,ASC)。ESC能够分化成人体几乎所有组织和细胞。而ASC是组织特异性干细胞,只能分化为所在组织的多种细胞类型。诱导多能干细胞(induced pluripotent stem cell,iPSC)是从成体细胞重新编程为类似ESC的细胞。干细胞能促进发育并维持机体稳态,而异常的自我更新和分化则可导致人体疾病发生,例如恶性肿瘤。干细胞的分化过程是由多种信号传导通路精细调控的动态事件,包括干细胞的内源性信号调控通路,干细胞与微环境之间的相互作用,以及表观遗传调控网络等。这些通路在维持干细胞多能性、自我更新及响应环境变化等方面发挥着至关重要的作用,共同决定了干细胞的命运抉择。
一、影响干细胞分化的内源性信号通路
干细胞分化是一个复杂的过程, Wnt、Notch、TGF-β和JAK/STAT等信号通路共同参与调控,这些通路相互影响,高度协作,精确调节干细胞的命运。
1. Wnt信号通路Wnt蛋白与细胞表面的Frizzled家族受体和低密度脂蛋白受体相关蛋白(LRP)5或6结合,激活下游多蛋白复合体的解聚,进而抑制GSK-3β对β-catenin的磷酸化,促使β-catenin在胞浆内积聚并入核与TCF/LEF家族转录因子结合,最终激活下游靶基因表达,从而影响细胞增殖、分化和凋亡。这一信号通路对维持干细胞功能也十分重要。在MSC中, 低水平的Wnt信号能够维持其自我更新和多能性,而高水平Wnt信号则促进成骨分化。Wnt信号对ESC向中内胚层分化起关键作用。Wnt信号的激活还可以促进小鼠肺泡Ⅱ型(AT2)干细胞的增殖,这对肺上皮损伤修复具有潜在的治疗意义。此外,Wnt/β-catenin信号通路的异常激活与肿瘤发生密切相关,如在三阴性乳腺癌中,Wnt信号与肿瘤干细胞(cancer stem cell,CSC)的激活和多药耐药性密切相关。
2. Notch信号通路Notch信号通路是在进化上高度保守的细胞间通信机制。相邻细胞表面的Notch配体与受体结合后触发Notch信号的活化,引发蛋白水解反应,生成有活性的Notch细胞内域(Notch-ICD),并进一步转移到细胞核,结合效应蛋白和转录激活蛋白,从而调控靶基因表达。Notch信号通路对于维持干细胞的自我更新及多能性状态具有重要意义。例如,在造血干细胞和神经干细胞中,Notch信号是维持干细胞特性的关键因素。在癌症发生中,Notch信号通路的失调会促进肿瘤细胞的增殖、转移和血管生成,并对CSC的自我更新和药物抗性也起着决定性作用。
3. TGF-β信号通路转化生长因子β(TGF-β)超家族主要通过其成员骨形态发生蛋白(BMPs)和TGF-β等调控胚胎发育、组织发展及干细胞命运。当TGF-β配体结合到其Ⅱ型受体上,并促使其磷酸化Ⅰ型受体,进而激活下游的转录因子Smad蛋白形成转录因子复合物入核,与其他辅助因子相互作用,激活或抑制靶基因转录。TGF-β信号通路在干细胞中的作用较为复杂。TGF-β/activin信号通路在人胚胎干细胞(hESC)的多能性维持中扮演着重要角色,但是对小鼠胚胎干细胞(mESC)的多能性却没有影响。此外,笔者所在课题组曾报道p53家族因子可以协同调控TGF-β和Wnt信号通路共同促进mESC向中内胚层分化。并且,笔者所在课题组最近又发现TGF-β信号通路可以在不依赖Smad4的情况下,通过活化的Smad2/3促进DNA甲基转移酶3b(Dnmt3b)的表达,并与其互作,共同促进多能性mESC向始发态上胚层进行转变。在ASC中,TGF-β家族信号通过自分泌或微环境中的蛋白因子维持干细胞特性。例如, 静止期的毛囊干细胞通过TGF-β信号被激活以进行再生。此外,TGF-β诱导的上皮-间充质转化在乳腺癌和正常乳腺干细胞的干性获得中起着关键作用。
4. JAK/STAT信号通路JAK/STAT通路由多种细胞因子和生长因子激活,通过JAK蛋白的磷酸化激活STAT蛋白,进而促进STAT蛋白二聚体的形成和核内转移,调控特定基因表达。在果蝇中,JAK/STAT信号通过Upd1、Upd2和Upd3等配体激活,影响干细胞的增殖和维持。在哺乳动物中,该通路的激活对干细胞的自我更新和多能性至关重要。JAK/STAT通路在调控干细胞行为中的作用不仅限于单一通路,而是与其他信号通路如Notch、Hippo、Insulin和TOR等存在互作,共同调节干细胞分化和组织再生等行为。此外,JAK/STAT通路的异常激活与多种疾病有关,包括免疫介导的疾病和癌症。在CSC中,JAK/STAT通路的激活促进ZEB1/2表达,后者通过抑制miRNAs表达,上调干细胞因子表达,促进了CSC的上皮-间质转化和转移。
二、细胞外环境对干细胞分化的影响
体内干细胞周围的特定动态微环境称为干细胞微环境,它对于维持干细胞的自我更新和多向分化潜能起着重要作用。干细胞和微环境可以在发育过程中相互诱导,并在成年后相互发出信号以维持彼此。在胚胎发育过程中,微环境作用于ESC,改变其基因表达,诱导其增殖或分化,从而促进胎儿的发育。在人体内,干细胞微环境能使ASC保持静止状态,但在组织损伤后,微环境会主动向ASC发出信号,促进自我更新或分化形成新组织。
在微环境中,多种因素直接参与了干细胞的功能调控,包括干细胞间的相互作用、干细胞与邻近分化细胞或黏附细胞间的相互作用、细胞外基质成分(extracellular matrix,ECM)、生长因子、细胞因子、氧张力、剪切力和环境的理化性质(包括pH值、离子强度和代谢物)等(图1)。例如,ECM通过调节其组成成分的产生、降解和重塑,对特定器官发育和功能修复发挥作用。微环境内的信号传递对维持干细胞功能和自我更新至关重要。分泌因子不仅可以在局部1~2个细胞间发挥作用,也可以在整个微环境中扩散以指导干细胞命运。此外,细胞黏附分子可以将干细胞保留在微环境中,而且干细胞与微环境的细胞或ECM成分直接相互作用产生的机械力,也可以对干细胞的功能产生深远影响。
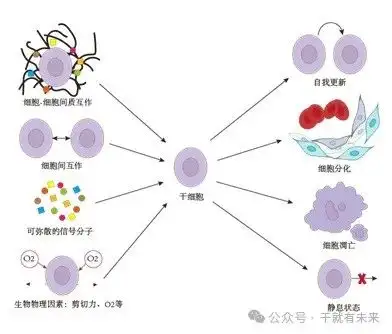
图1 干细胞微环境的关键组成部分
三、干细胞分化的表观遗传调控
表观遗传调控包括DNA甲基化、组蛋白修饰、非编码RNA和染色质重塑等调控机制能够从多维度影响干细胞的命运和功能(图2)。
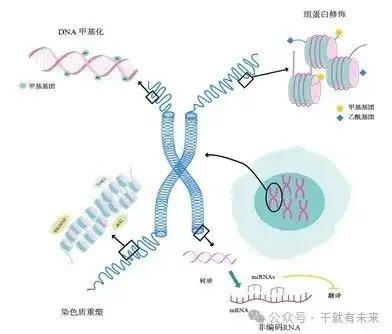
图2 表观遗传调控
1. DNA甲基化
DNA甲基化主要发生在CpG位点上,通过在DNA分子胞嘧啶的5'位置添加甲基基团来调控基因表达。这一修饰将直接抑制转录因子与甲基化DNA结合,或者需要招募改变甲基化区域染色质构象的染色质修饰酶来调控基因表达。此外,DNA甲基化参与异染色质的形成和维持,这对于沉默重复元素和维持干细胞中的基因组稳定性至关重要。这种修饰在调控基因表达、细胞命运决定、X染色体失活、基因印记及转座子沉默等方面发挥着重要作用。DNA甲基化模式是动态调控的,可以通过TET家族酶的活性被逆转,这些酶将5-mC氧化为5-hmC,启动主动去甲基化过程。ESC具有独特的甲基化景观,它在早期胚胎发育期间发生全局性去甲基化,随后与细胞分化同步建立新的甲基化标记,从而沉默多能性因子并促进分化因子的表达。在mESC向上胚层样细胞(EpiLC)转变的过程中,Dnmt3b的表达显著上调。一方面,Dnmt3b通过抑制多能性因子例如Sox2的表达来促进mESC多能性的逐步退出;另一方面,Dnmt3b结合上胚层基因包括Fgf5的顺式作用元件周围,促进Smad2/3与低甲基化中心结合,激活上胚层特异性基因的表达。此外,DNA去甲基化是体细胞重编程为iPSC的关键事件,使用DNA去甲基化剂,如5-氮杂胞嘧啶,可以提高重编程效率,为理解细胞命运的可逆性开辟了新途径。
2. 组蛋白修饰组蛋白修饰指在组蛋白的氨基酸残基上进行的诸如甲基化、乙酰化、泛素化及巴豆酰化等一系列修饰,不同修饰组合对于靶基因的表达及功能的影响各不相同,进而影响干细胞的命运。在ESC和iPSC的谱系基因的启动子区域,组蛋白H3第4位(H3K4)和第27位(H3K27)的赖氨酸能在组蛋白甲基化转移酶的催化下发生三甲基化修饰。它们所形成的二价标记能维持基因在转录激活和抑制之间的平衡,保持蓄势待发的状态(poised)。在神经干细胞和iPSC中,去除H3K27me3能促进神经分化,而去除H3K9me3则能维持神经干细胞的自我更新和增殖。在精原干细胞中,H3K4的去甲基化修饰影响其分化过程。在人骨髓间充质干细胞中,H3K9的乙酰化和二甲基化修饰与基因启动子区域的活性密切相关,参与维持MSC的自我更新和多能性。多梳复合物介导的H2A泛素化(H2Aub)在神经发生潜能受阻时显著增加。这表明组蛋白修饰在调控神经前体细胞命运中也发挥了重要作用。此外,在CSC中,使用DNA甲基转移酶抑制剂或组蛋白去乙酰化酶抑制剂,可以抑制CSC活性。
3. 非编码RNA
非编码RNA(non-coding RNA,ncRNA)是一组在细胞内执行调控功能但不参与蛋白质编码的RNA分子,根据长度和结构特征主要分为微小RNA(miRNA)、长链非编码RNA(lncRNA)和环状RNA(circRNA)三类。不同类型的ncRNA通过参与染色质结构改变、细胞信号传导等过程,在多种干细胞内发挥调控作用。miR-302家族通过靶向细胞周期抑制因子,促进细胞周期进展,维持ESC及iPSC多能性。let-7家族miRNA在多种肿瘤细胞中下调,与CSC的成瘤能力密切相关。而lncRNA,如ROSE1和lincRNA-ROR,在iPSC的生成与维持中扮演关键角色。lncRNA还可以调控ASC的分化和组织再生能力。例如,lncRNA通过影响特定miRNA的表达来调控神经干细胞的分化和功能。此外,心脏干细胞中特定的circRNA可以通过海绵化miRNA,参与心脏修复和再生过程。
4. 染色质重塑染色质重塑是一种细胞内部的动态调控过程,涉及特定蛋白质复合物对染色质结构的调整,以实现对基因表达的宏观调控。该过程主要包括核小体的重新定位、组蛋白尾部共价修饰及DNA重塑,这些活动共同作用于改变染色质的紧密程度,从而影响转录因子及其他染色质结合蛋白对DNA的访问。此外,染色质重塑还参与细胞对环境信号的响应,通过改变染色质结构,使细胞能够快速调整其基因表达模式,适应不同的分化需求。染色质重塑对干细胞的多能性、自我更新及分化过程具有深远影响。例如,染色质解螺旋酶DNA结合蛋白(CHD4)是核小体重塑和脱乙酰酶(NuRD)复合体的亚基,能维持ESC的多能性并抑制分化转录因子的表达。在肝细胞癌中,CSC的成瘤能力和化疗抗性也与CHD4的表达水平相关。在造血干细胞中,染色体异常如Trisomy 8通过改变染色质结构和RUNX1转录因子的功能,影响干细胞的自我更新和分化能力。染色质的三维结构也在干细胞分化中起着关键作用,例如拓扑关联域和增强子与启动子之间的环状连接都可以调控基因的表达。这些研究揭示了染色质重塑在干细胞命运决定中的多样化作用机制,为理解干细胞功能、开发新的治疗策略提供了新视角。
四、结语
干细胞分化是一个复杂且多层面的过程,受到细胞外环境、信号通路、表观遗传修饰等多种因素的影响。尽管面临挑战,随着科学家对干细胞分化调控网络的深入理解,其在临床治疗中的应用前景广阔,未来有望开发出更有效的治疗方法,维护人类健康。例如,对干细胞及其生态位的深入理解能促使科研人员开发出各种生态位工程技术,建立人工生态位来调控干细胞命运。通过结合信号转导、表观遗传调控及新兴的多组学技术,可以从多维度理解干细胞的发育轨迹和命运调控机制,以及它们在不同生理和病理状态下的功能,从而充分发挥干细胞治疗的潜力。此外如何预防干细胞衰老也是一个极具前景的方向,这对于维持组织稳态和研究器官再生至关重要。