产品中心
技术交流

扫描二维码
定了!全球首款外泌体细胞疗法审批决定日期为今年8月
来源:谈思生物
导读:美国FDA已受理Capricor公司提交的细胞疗法deramiocel的生物制品许可申请(BLA),并授予优先审评资格,PDUFA目标行动日期定于2025年8月31日。如果获批,该疗法将成为首款治疗杜氏肌营养不良症(DMD)心肌病的药物。
当地时间3月4日,Capricor Therapeutics公司宣布,美国FDA已接受其提交的“first-in-class”细胞疗法deramiocel的生物制品许可申请(BLA),该疗法用于治疗杜氏肌营养不良症(DMD)相关心肌病患者。此外,FDA授予该BLA优先审评资格,PDUFA目标行动日期定于2025年8月31日。新闻稿指出,如果获批,deramiocel将成为首款用于治疗DMD心肌病的疗法。杜氏肌营养不良症(DMD)是一种进行性肌肉萎缩疾病,其特征是骨骼肌、心脏和呼吸肌的进行性无力和慢性炎症,患者中位死亡年龄约为30岁。据估计,DMD在每3500名男性新生儿中会发生1例。DMD的病理机制是由于功能性肌营养不良蛋白的生成受损,这种蛋白是肌肉中的重要结构蛋白。肌肉细胞中功能性肌营养不良蛋白的减少会导致细胞严重受损,最终引发肌肉细胞死亡和纤维化替代。在DMD患者中,心肌细胞会逐渐死亡并被瘢痕组织替代,这种心肌病最终导致心力衰竭,目前是DMD患者的主要死亡原因。目前,DMD的治疗选择有限,且尚无治愈方法。Deramiocel的BLA申请主要基于2期临床试验HOPE-2及其开放标签扩展(OLE)试验中的现有心脏数据,并与自然病史数据进行对比。HOPE-2临床试验数据显示,患者在接受deramiocel治疗1年后,与自然病史数据相比,上肢功能衰退速度减缓了71%,而评估心脏功能的指标不仅没有恶化,反而有所改善。

▲ HOPE-2的临床试验数据显示骨骼肌和心脏功能的统计显著改善(图片来源:公司官网)此外,之前公布的HOPE-2开放标签扩展(OLE)研究的三年随访数据表明,接受deramiocel治疗的患者在三年内的心脏和骨骼肌功能保持稳定。患者的心脏功能多项指标均有所提升,例如左心室射血分数和容积指数等,这些指标与长期心脏预后密切相关。此外,在HOPE-2研究结束时,射血分数大于45%的患者显示出更显著的治疗效果,这进一步证实了早期和持续治疗对于缓解DMD心肌病影响的重要性。HOPE-2 OLE研究还持续证明了deramiocel长期治疗的安全性良好。
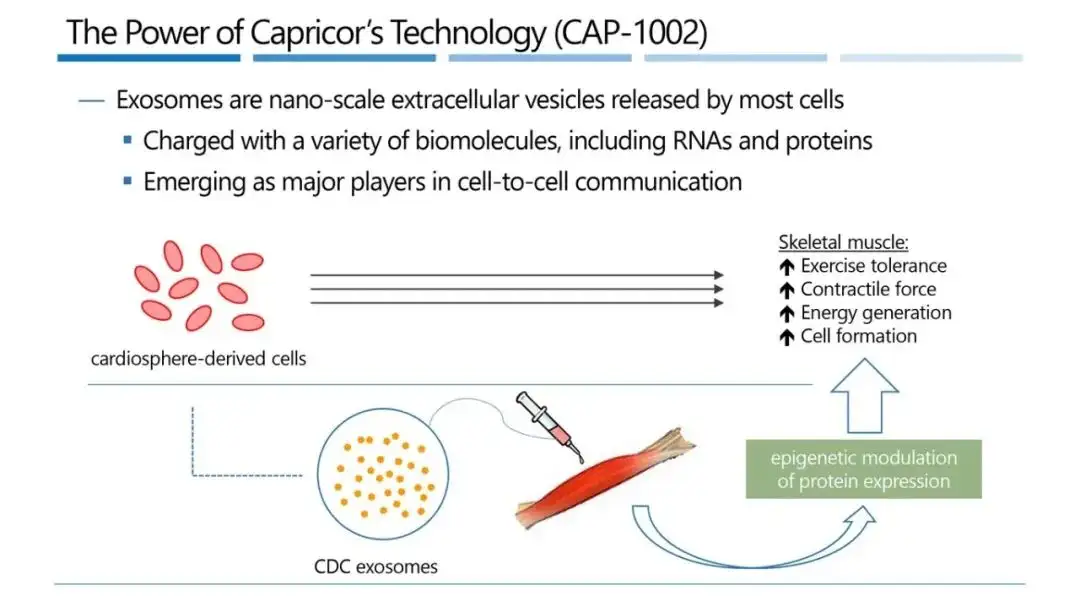
▲ CAP-1002的作用机制(图片来源:公司官网)
Deramiocel(也称CAP-1002)是一种基于心脏来源细胞(CDCs)的同种异体外泌体细胞疗法。CDCs通过分泌外泌体这种细胞外囊泡来发挥作用,外泌体能够靶向巨噬细胞并改变其表达谱,促使其呈现修复表型而非促炎表型。在临床前和临床研究中,deramiocel已显示出强大的免疫调节、抗纤维化和再生能力,可用于治疗肌营养不良和心力衰竭。此前,美国FDA已授予deramiocel再生医学先进疗法(RMAT)认定和孤儿药资格。新闻稿指出,如果Capricor公司在2026年9月30日前获得FDA关于deramiocel治疗DMD的上市批准,根据此前获得的罕见儿科疾病资格认定,Capricor将有资格获得优先审评券(PRV)。Capricor公司首席执行官Linda Marbán博士表示:“我们非常高兴生物制品许可申请已获受理,这让我们距离为杜氏肌营养不良心肌病患者提供首创疗法的目标更近了一步。目前这种疾病尚无获批疗法。如果申请获批,我们预计deramiocel将成为一种终生治疗方案,每季度给药一次,并有望在DMD心肌病治疗领域得到广泛应用。”值得一提的是,早在2022年,Capricor就与日本新药株式会社(Nippon Shinyaku)签订了独家商业化和分销协议。根据协议,Capricor获得了3000万美元的预付款,并可能获得高达7.05亿美元的额外里程碑付款。2023年,双方再次合作,日本新药株式会社获得在日本独家商业化和分销CAP-1002的权利。根据协议,Capricor收到1200万美元预付款,并可能获得高达8900万美元的开发和销售里程碑付款。2024年9月,Capricor与日本新药株式会社再次签订商业化和分销协议。根据协议,日本新药株式会社将在欧洲负责CAP-1002的商业化和分销。Capricor将获得1500万美元股权投资(含20%溢价)和2000万美元预付款,整体协议潜在价值约15亿美元。免责声明:本文内容来源于官方网站,旨在为大家提供知识共享,不构成任何专业建议。本资料中所涉及的图片及文字内容仅供参考,目的是为了将好的内容分享给更多人,版权依旧归原作者所有,若侵犯肖像权或者著作者权等知识产权,请联系我方删除。
信息来源:医麦克