产品中心
技术交流

扫描二维码
不限癌种 | 抗肿瘤药物的泛肿瘤开发
来源:文森特谈临研
今天介绍不限癌种的泛肿瘤开发模式。结合FDA《不限组织类型的肿瘤药物研发指导原则草案》,一起来看看,如何通过泛肿瘤研究加速药物开发,实现精准治疗。
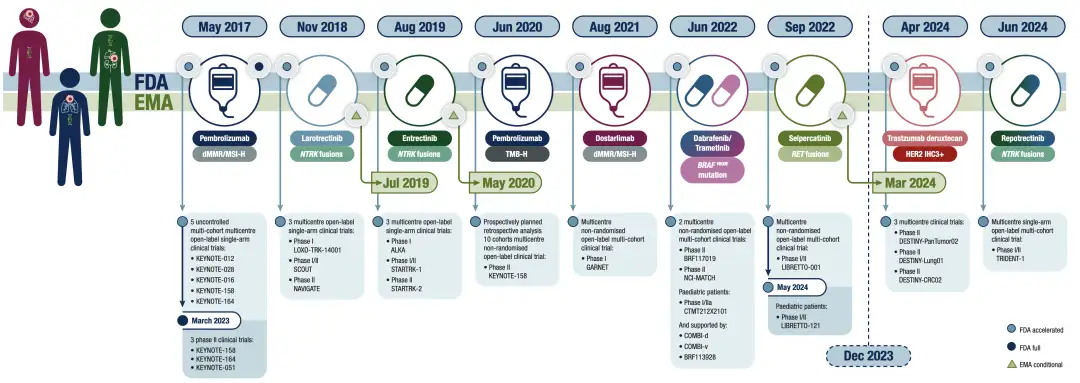
截至2024年上半年FDA和EMA批准的不限癌种的适应症;国内CDE 也已批准帕博利珠单抗、恩沃利单抗和斯鲁利单抗用于MSI-H/dMMR实体瘤不限癌种适应症
不限癌种(Tumor Agnostic)/不限组织(Tissue Agnostic)/泛肿瘤(pan‐tumor) 是指药物靶向多种癌症类型出现的一种特定分子改变。这种分子改变包括广义上一系列DNA、RNA或蛋白水平的分子变化,包括点突变、基因融合、突变负荷、抗原负荷、表观遗传改变和表达的上调或下调等等。
不限癌种的肿瘤药物可以通过靶向一种分子改变,用于多种肿瘤类型的治疗。
目前多种治疗类型,包括靶向治疗、免疫治疗、以及ADC(T-Dxd) ,都已有不限癌种的适应症获批。
不限癌种的泛肿瘤开发,和传统抗肿瘤开发的一个关键区别,是基于生物学基础和临床疗效,前者旨在将基于某些肿瘤中观察到的治疗效果外推到具有相同分子改变的其他肿瘤,即使这些其他肿瘤类型在临床试验中未入组或仅有少量入组。
如果治疗效果与肿瘤特异性的生物学特征无关(如NTRK),则适合采用不限癌种型的开发方式。
相对应地,传统肿瘤开发中肿瘤调节型(tumor-modulated),即治疗效果受到肿瘤特异性生物学特征调节(如PARP); 肿瘤限制型(tumor-resitricted),即治疗效果仅在肿瘤特异性的生物学环境中有效(如PI3K)。
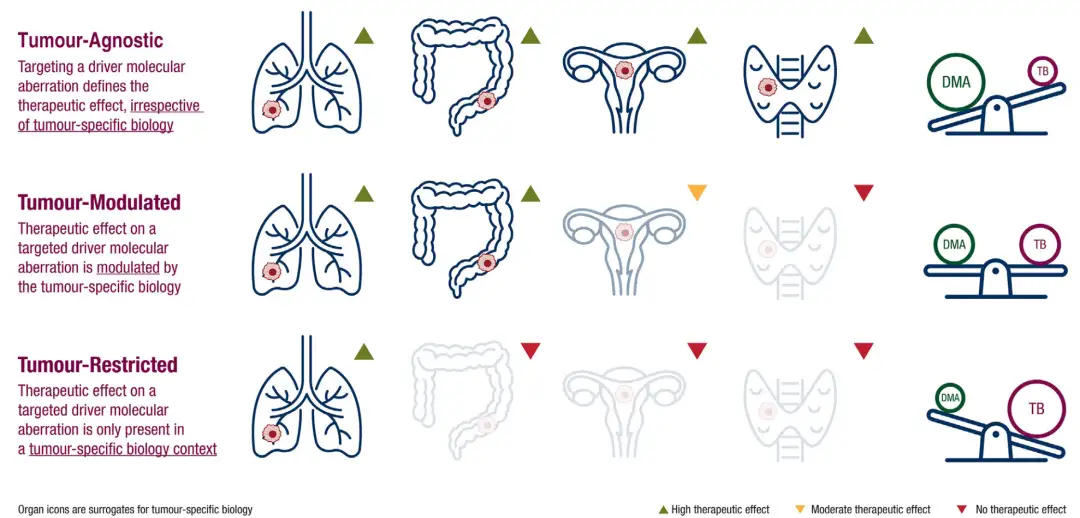
随着分子生物学的进展和测序技术的不断普及,使得依据肿瘤驱动突变的精准治疗成为可能。
不同器官的肿瘤可能起源于共同的分子改变,而相比发生部位,这些遗传学变化可能是驱动肿瘤发生和进展更本质的原因。直接针对这些分子改变的抗肿瘤药物开发,可能更为有效和高效。
因此,即使依据有限肿瘤类型的数据外推到不限癌种的适应症会带来一些不确定性,但在充分科学依据、临床数据和未满足需求的前提下,不限癌种的开发开始逐渐被FDA等监管所接受。
治疗更精准:靶向明确的分子改变,针对肿瘤生长的根本原因,可能带来更有效的治疗效果。
人群更广泛:在每个肿瘤类型中入组足够数量的受试者进行研究是不可行的,尤其是对于发病罕见的肿瘤,而不限癌种的开发使得发生特定分子改变的罕见肿瘤有了治疗的机会。
开发更高效:相比在各个瘤种中进行单独的临床研究,不限癌种的开发可以汇总各瘤种中的数据,极大地加速临床开发。
考虑开展不限瘤种开发的总体原则,是科学和临床的合理性(scientifically and clinically appropriate),体现在包括生物学、研究人群以及临床数据(临床药理和临床安全性有效性) 等方面。
对肿瘤生物学的理解是进行不限癌种开发的科学基础,包括肿瘤分子病理生理、 药物作用机制,以及肿瘤对药物的反应等。
进行不限癌种的开发,需要对分子改变有深入的理解,包括分子改变如何影响肿瘤的自然史。自然史研究可以提供支持性信息,帮助了解与不含靶向的分子改变相比,患者在预后方面的差异。
申办方需要了解分子改变在不同肿瘤类型的分布来决定合适的开发方式。基于生物学理解,有些情况下不适合不限癌种的开发,比如一些肿瘤类型的原发或获得性耐药,导致治疗效果在瘤种间的异质性。
依据分子改变在研究人群瘤种之间的分布不同,也会影响不限癌种的开发策略。
如果分子改变在各肿瘤类型中都非常罕见,如NRTK基因融合,则不限癌种开发相比传统以瘤种为基础的开发策略更可行。
如果分子改变在某些瘤种中更常见,如RET基因融合在甲状腺癌和肺癌中相比其他肿瘤中更常见,FDA建议应先评估是否可以在相对高发的肿瘤类型中开发。而不限癌种的研究,纳入初始申请以外的瘤种,可作为补充适应症申请。
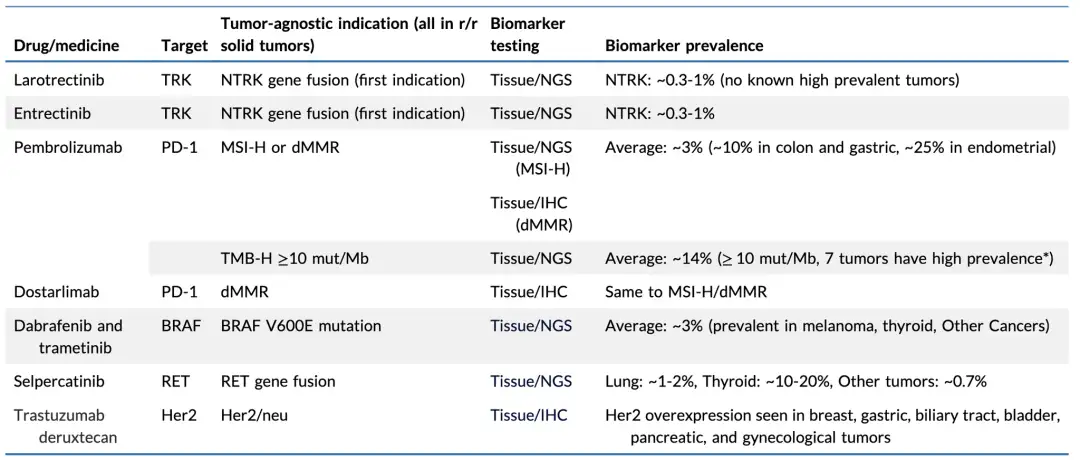
临床药理信息有助于判断是否适合进行不限癌种开发。
瘤种间PK/PD差异:通过临床药理数据,判断不同肿瘤类型之间是否可能存在有意义的PK/PD差异,例如由于患者因素、肿瘤负荷或者肿瘤位置导致的差异等。
暴露-反应模型: ER模型有助于确定药物清除率是否因肿瘤类型不同而导致药物暴露的显著差异。申办方需解释这些差异是否具有临床相关性,由此带来不同瘤种之间的安全性或有效性差异,导致不适合进行不限癌种的开发。
剂量选择的考虑:进行不限癌种的开发还需要考虑相同剂量是否适用于所有肿瘤类型。如果可能影响药物暴露的因素在某些瘤种中更常见(如肝癌中肝功能受损更常见),需要考虑是否出于PK因素,在开发中排除特定的肿瘤类型。
考虑不限癌种的开发,还需要结合临床安全性和有效性信息。
有效性考虑:进行不限癌种开发前,需结合早期研究观察瘤种间是否存在缓解率的差异。如发现某些肿瘤类型缺乏响应,并且排除小样本量的偶然性而考虑存在真实的疗效差异,则应将开发限于缓解率相应阈值水平以上的瘤种。
样本量:申办方需要就不限癌种的研究中不同瘤种入组的数量提供充足的依据。对于发病率相对较高的肿瘤,需要足够的样本量,以使得临床结果具有代表性。
安全性考虑:申办者应考虑药物是否存在限制在特定人群中使用的安全考虑因素。对于特定的风险(如肝肾功能损害限制在特定瘤种中使用),可能会体现在不限癌种适应症的说明书信息中。
不限癌种的开发需要依据疾病、患者人群、未满足需求以及非临床和早期临床获得的药物信息来开展。
初始药物研究可以采用不同模式在特定人群中开展,如:1.在一个或少数亚组人群中; 2.多个亚组人群中; 3. 排除某些特定亚组人群。依据早期临床的数据,可以提示后续进行不限癌种或特定肿瘤的开发。
如果申办方计划针对某种分子改变的药物,用于不限癌种的适应症,同时在特定肿瘤的开发中单独开发,还需要解释在特定肿瘤中纳入分子标志物阳性的人群对有效性的影响,对药物在标志物阴性人群中效果也需要有了解。至少需要了解分子改变在特定肿瘤中的发生率。一些情况下,FDA可能要求在标志物阴性人群中开展单独的分析。
不限癌种研究的患者选择,也还需要考虑纳入的瘤种范围,并进行充分的安全性评估。
对于一些复杂的分子改变,比如带有多个融合伴侣的融合基因或连续性标志物等,在不限癌种的开发中需要提供依据,表明纳入了适当特定肿瘤类型和标志物定义的肿瘤,并且有效性结果没有偏向特定的类型。
不限癌种的试验设计,与传统开发一样取决于多种因素,包括目前可及治疗、未满足需求、前期观察到获益程度以及患者人群大小。
早期研究在不同瘤种中的研究或扩展队列中的数据,有助于提示是否适合开展后续的不限癌种研究。
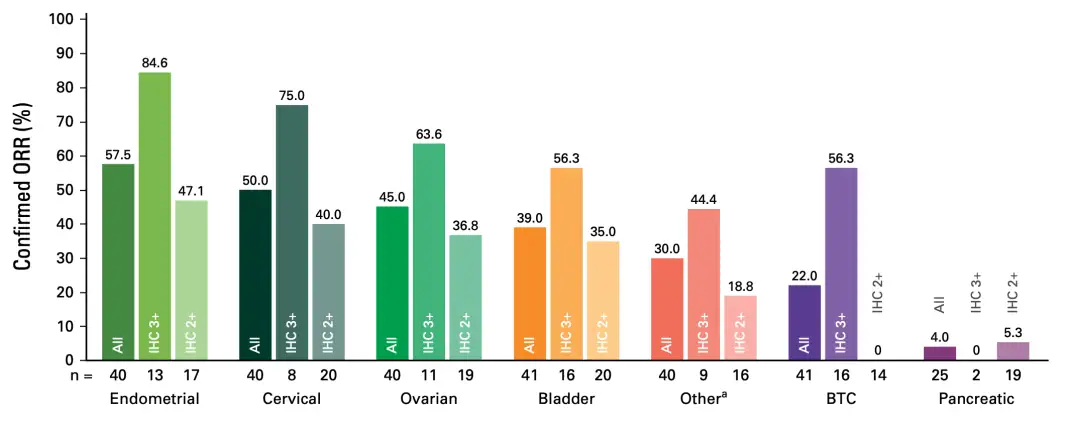
基于DS8201-A-J101扩展队列2d的积极数据,T-Dxd开展了DESTINY-Pantumor02泛肿瘤研究
单臂还是随机对照研究
在难治性、晚期、转移性肿瘤中进行不限癌种开发,可接受采用单臂研究,选择缓解率和持续时间作为主要疗效终点,并且在结果具有临床意义时支持批准(如加速批准)。
对于随机对照研究,一般来说在不限癌种的研究中存在限制。由于不同肿瘤的标准治疗和预后不同,因此要在随机中保持组间的平衡可能存在困难。
一些情况下,在特定肿瘤中的随机对照研究可能提示额外单独的不限癌种研究。在早期或已有满意治疗的特定肿瘤中,可能需要另行开展随机对照研究。另外如涉及联合治疗的开发,可能也需要随机对照研究来析因单个药物的疗效贡献。
对于不限癌种的开发,申办方需要预先提供每一项研究(或跨研究项目)中的患者和肿瘤类型数量,明确样本量。通常需要基于有意义的治疗效果提出研究假设,并且同时控制I类错误。也可以采用贝叶斯方法,但需要在启动研究前与FDA提前沟通。
由于不同分子改变在癌种中的分布不同,因此不限癌种开发的所需要的样本量也可能不同。
尽管统计分析计划是预先设定的,但FDA仍需要依据实际临床数据,来决定授予的适应症。比如入组的瘤种局限于某些肿瘤,批准的适应症也相应地局限。
当准确的分子改变检测对于药物的安全有效使用至关重要时,FDA要求其许可或批准的伴随诊断应在药物获批时市售可及,以便在医疗机构中识别患者。
标志物检测:对于不限癌种的伴随诊断开发有特殊的困难,如在不同肿瘤中样本收集和处理的异质性,以及用于检测多项标志物的组织样本有限。应用包括NGS在内的平台可帮助同时检测多种分子改变。
桥接研究:在不限癌种的研究中,可能会基于本地检测方法入组患者,申办方需要制定计划并留有足够的组织来进行桥接研究,并收集本地和中心检测的诊断性能信息。
IVD体外诊断:一般来说,如果IVD体外伴随诊断对于决定药物的安全有效使用是必须的,FDA通常不会在缺少IVD的情况下批准。这种情况下,FDA将综合疾病危及程度、有无满意替代治疗等来评估缺少FDA许可或批准的伴随诊断下批准药物的获益风险。
对于不限癌种的开发,通过上市后继续收集信息,可以在获批研究中无或仅少量患者入组的瘤种中,提供额外的有效性数据。
对于获得加速批准的适应症,或需要评估对于特定肿瘤类型的疗效,包括耐药机制以及缺乏疗效的瘤种,可能需要上市后研究。
对于上市后研究类型的要求,FDA指导原则草案中并未明确。考虑到不限癌种开发的特点,在获批研究中延长随访,或提供药物在特定瘤种或人群中的数据,应可支持从加速批准转为完全批准。
除以上考量以外,开展不限癌种的开发,还需要充分的非临床评估,并可考虑尽早开展儿科评估等。
今天介绍了不限癌种的泛肿瘤开发要点:
不限癌种是药物靶向一种特定分子改变,用于多种肿瘤类型的治疗。不限癌种开发可以将治疗外推到有相同分子改变的瘤种,相比传统抗肿瘤开发,具有治疗更精准、人群更广泛、开发更高效的优势。
开展不限癌种开发的条件,是需要具备科学和临床的合理性。生物学理解是进行开发的科学基础。分子改变在瘤种之间的分布会影响开发策略。临床药理和安全性、有效性信息也影响不限癌种的开发条件与研究设置。
不限癌种开发的考量要点,需综合考虑患者选择、试验设计、统计考虑、诊断考量以及获批后数据等要求。试验设计取决于多种因素,并需依照疾病背景考虑试验类型;统计方面需预先设定患者和瘤种样本量;充分考虑伴随诊断的要求;获批后可继续收集额外数据。
2017年帕博利珠单抗获批用于MSI-H/dMMR实体瘤,开启了不限癌种开发的篇章。
在此之后,多项靶向和免疫治疗泛肿瘤适应症相继获批,给原本难以被覆盖的患者提供了精准治疗选择。
2024年,T-Dxd成为首个获批泛肿瘤治疗的ADC,进一步拓宽了不限癌种治疗模式的应用。
不限癌种的泛肿瘤开发在其他靶点的探索不止于此,FGFR、KRAS G12C、NRG1、MTAP缺失等也相继有进展。
由于不同靶点的生物学和分布各异,不限癌种的开发还需要量体裁衣、因时制宜。
拨开荆棘,方能走出一条道路来。