GMP级或临床级rAAV定制
派真生物
GMP级rAAV定制
GMP级别rAAV载体和质粒的规模化生产及包装用于满足IND申报与基因治疗临床实验方面的迫切需求。派真生物基于自主知识产权的rAAV上游发酵和下游分离纯化工艺,依据GMP的验证规范与实施标准,提供从质粒构建、细菌库、细胞库、工艺开发到大规模的AAV生产技术服务,提供原辅料、制品及制剂的 质量研究和方法学开发验证,还提供工艺转移及方法学转移、IND申报药学研究资料撰写等技术服务,满足基于AAV的基因治疗从IND申报到临床试验阶段的项目需求。
派真生物成功建立了高水平的腺相关病毒(rAAV)载体开发与规模化生产平台,按照国际领先的“一次性技术与单向流”设计理念,基于高纯度、高滴度、高感染的rAAV生产及病毒包装方面的核心知识产权,提供从载体构建、菌种库、细胞库、工艺开发与优化、临床级质粒生产、AAV大规模生产、质量方法学开发研究与验证等整体解决方案。派真生物现已有600平方米GLP研究级别AAV生产平台、500平方米GMP中试车间(满足IIT和IND申报生产要求),同时4000平方米大规模GMP基地正在加快建设中。派真生物按照GMP标准建立并完善质量控制体系,采用优化的rAAV工艺开发与生产策略,高产上游表达和高回收率的下游纯化工艺,从而有效地提高菌种质粒与细胞株rAAV产量,满足AAV基因治疗从IND申报到临床试验阶段的项目需求。

派真生物拥有病毒工艺开发、规模化生产与放行经验,提供高质量的临床级rAAV生产及包装服务,包括细胞库建立、工艺开发、方法学开发、稳定性研究,中试批生产等,可以根据项目需求定制服务内容。根据临床申报要求,派真生物将提供临床级rAAV、批生产记录、菌种鉴定报告、样品制造记录、批检定记录和方法学验证等。
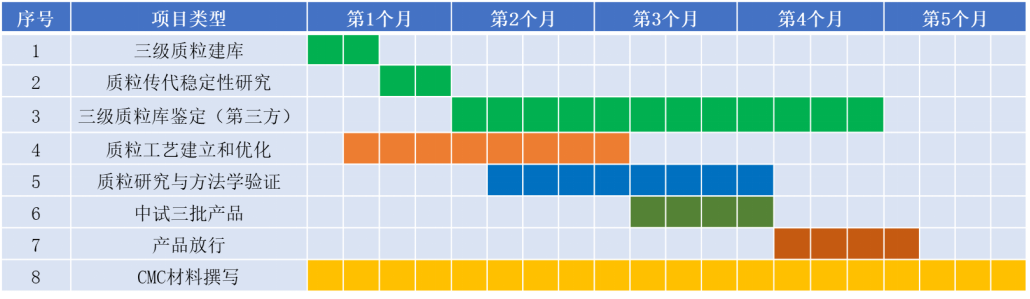
派真生物rAAV的GMP项目周期一览表

派真生物还提供GMP级质粒工艺开发、规模化生产与放行、CMC材料撰写等服务。
派真生物质粒GMP服务项目周期一览表
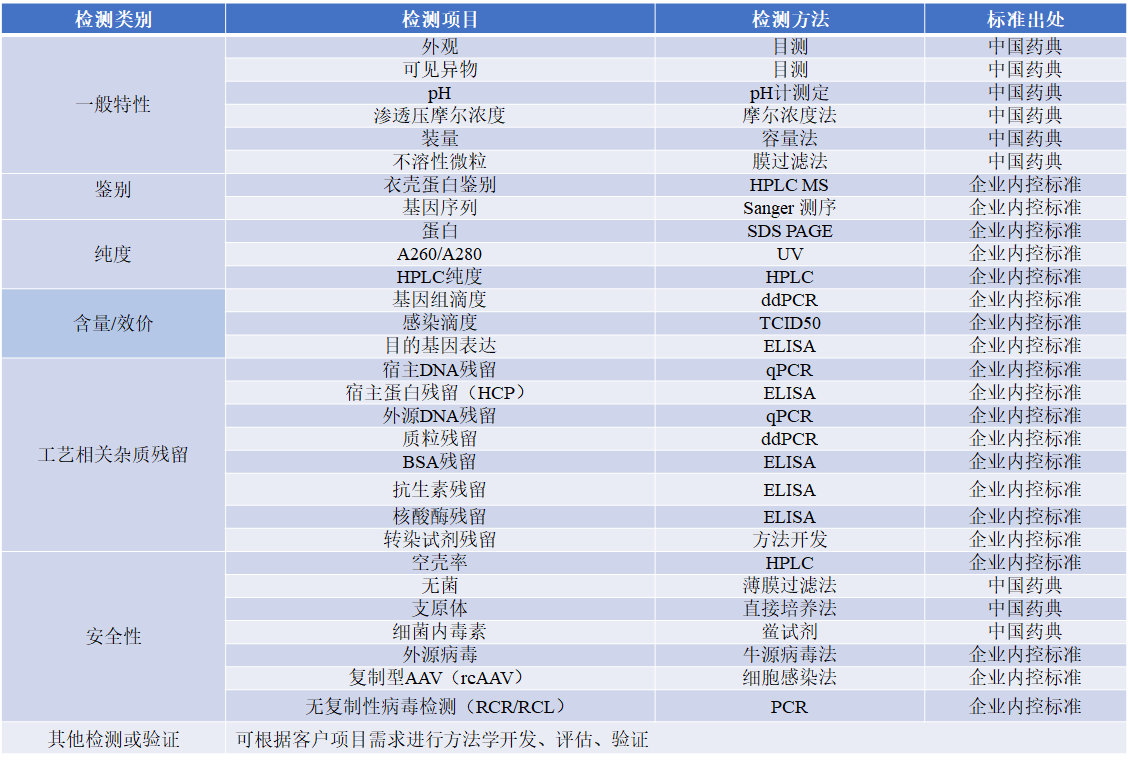
rAAV载体质量检测按照药典标准与国内外法规要求,根据基因疗法制品的关键质量属性,利用对基因治疗载体的深入了解和丰富经验,基于质量源于设计(QbD)理念,派真生物建立了完备的质量控制策略、方法学开发和工艺参数验证,提供GMP级别rAAV样品批检验与质量方法学开发验证服务。
| 货号 | 名称 | 品牌 | 购买 |
|---|